印刷(PDF/664KB)はこちらから 2017年08月01日 研究開発
FOPにおける骨化を抑える方法の発見〜FOPの異所性骨形成のシグナル伝達メカニズムの解明〜
ポイント
- 著者らの先行研究により、アクチビンA注1)によるBMP注2)シグナルの異常活性化が進行性骨化性線維異形成症(Fibrodysplasia Ossificans Progressiva; FOP)の異所性骨化の原因であることがわかっていた
- FOP患者さん由来の細胞とアクチビンAを用いたハイスループットスクリーニングを実施し、mTOR注3)シグナルの活性化が異所性骨化を惹き起こすことを見出した
- 異所性骨化を抑える薬の候補としてラパマイシン注4)を同定した
1.要旨
日野恭介研究員(CiRA増殖分化機構研究部門、大日本住友製薬株式会社)、戸口田淳也教授(CiRA増殖分化機構研究部門)、池谷真准教授(CiRA未来生命科学開拓部門)らの研究グループは、FOP患者さん由来のiPS細胞を使い、FOPの異所性骨形成のメカニズムを解明し、治療薬候補を見出しました。
これまでの研究からFOPはACVR1注5)という遺伝子の突然変異がおこっており、そこにアクチビンAの刺激が加わると異常な骨形成シグナル(BMPシグナル)が伝わり、異所性骨化が生じることがわかっていました。本研究ではアクチビンAの刺激からなぜ異所性骨化が生じるのか、その分子メカニズムを解明するとともに、治療薬候補を探索するために、FOP患者さん由来の細胞から作ったiPS細胞を利用し、ハイスループットスクリーニング注6)を実施しました。約7,000の化合物をスクリーニングし、mTORシグナルが重要であることを突き止めました。また、異所性骨化のモデルマウスでもmTORシグナルの重要性を確認しました。さらに、ACVR1変異とmTORシグナルを結びつける分子として、ENPP2を同定しました。これらの結果から、FOPの異所性骨化は、アクチビンA、ACVR1、ENPP2、mTORの経路が主要因であることがわかりました。また、骨化を抑えるためにはラパマイシンという薬剤が有効である可能性を示しました。
この研究成果は2017年7月31日16時(米国東部時間)に「The Journal of Clinical Investigation」で公開されます。
2.研究の背景
FOPは筋肉や腱、靭帯などの軟部組織の中に異所性骨とよばれる骨組織ができてしまう病気で、200万人に1人程度の割合、本邦内には約80名の患者さんがいると言われている希少難病の一つです。著者らのこれまでの研究により、この病気は骨形成を司る増殖因子であるBMPの受容体の1つであるACVR1遺伝子に突然変異が生じて変異型ACVR1へと変化することが原因であることがわかっています。
これまでに研究グループは、FOP患者さん由来のiPS細胞(FOP-iPS細胞)や、変異型ACVR1遺伝子を修復した対照iPS細胞(resFOP-iPS細胞)の作製に成功しています。また、iPS細胞から間葉系間質細胞(induced mesenchymal stromal cells; iMSC)を経て軟骨へと分化させる方法も確立しており、FOP細胞では軟骨への分化能が亢進していることを確認していました(参照:CiRAプレスリリース2015/03/13)。
さらにこれらの細胞を用いて、本来は別のシグナルを伝えるアクチビンAが、FOP細胞ではBMPシグナルを異常に伝達していることを明らかにしました。また、FOP-iPS細胞から作製した間葉系間質細胞(FOP-iMSC)をアクチビンA発現細胞と共に免疫不全マウスに移植することで、患者さん由来細胞を用いた異所性骨形成モデルの作製にも成功していました(参照:CiRAプレスリリース2015/12/01)。
今回の研究では、FOP-iPS細胞を用いて化合物を探索するハイスループットスクリーニングシステムを構築し、アクチビンAによって引き起こされるシグナルがどのように伝達されているのか調べるとともに、治療薬候補の探索を試みました。
3.研究結果
1. ハイスループットスクリーニングによる薬剤候補物質の絞込
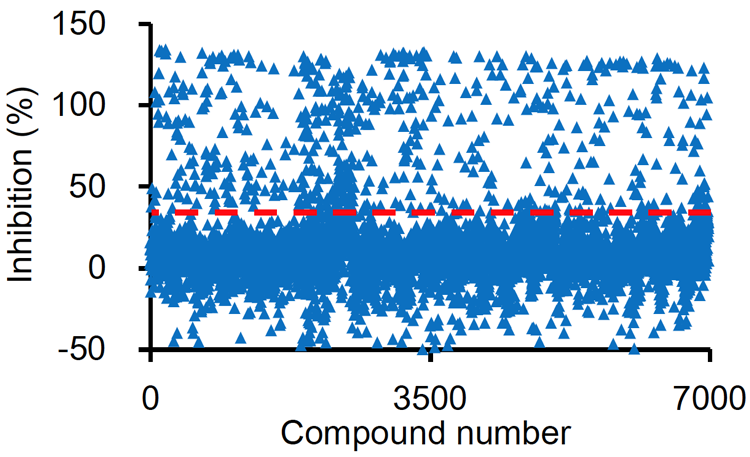
FOP-iPS細胞にアクチビンAのシグナルに反応して誘導される軟骨分化の程度を発光で検出する仕掛けを施した細胞(FOP-5xA-Luc-iPSC)を用意しました。その細胞を間葉系間質細胞へと分化させ、そこに6809種類の化合物を与えて発光強度を測定し、アクチビンA添加後の軟骨分化をそれぞれの化合物がどの程度阻害しているのか調べました。すると、40%以上阻害した化合物が549種類ありました(Fig. 1)。そこからさらに、細胞毒性が低く、阻害作用が強いもの76種類に絞り込みました。それらの化合物を機能から18のグループに分け、特に5種類の化合物が含まれるmTOR阻害剤のグループに着目して研究を進めました。
2. ラパマイシンが異所性骨化を抑制する
FOP-iPS細胞から作製した間葉系間質細胞(FOP-iMSC)をマウスに移植した異所性骨を形成するモデルを使い、mTORシグナルを抑制する化合物の効果について調べました。アクチビンA刺激により作られる異所性骨の形成は、mTORの阻害剤であるラパマイシン(Rapamycin)を投与することで抑えられました(Fig. 2)。
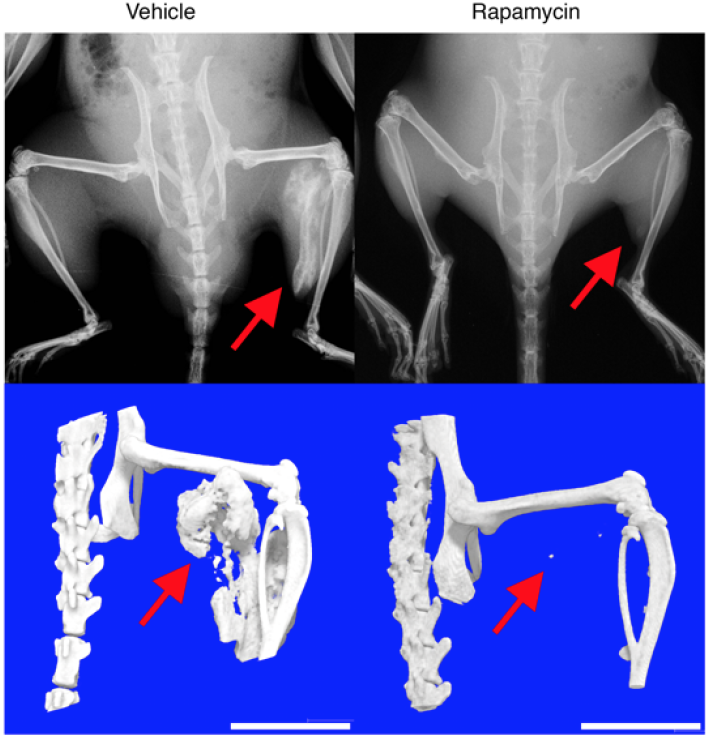
Rapamycin: アクチビンA刺激に加えラパマイシンを投与
矢印の付近にアクチビンの刺激を与えた。
3. アクチビンAの刺激はENPP2を介してmTORシグナルを活性化する
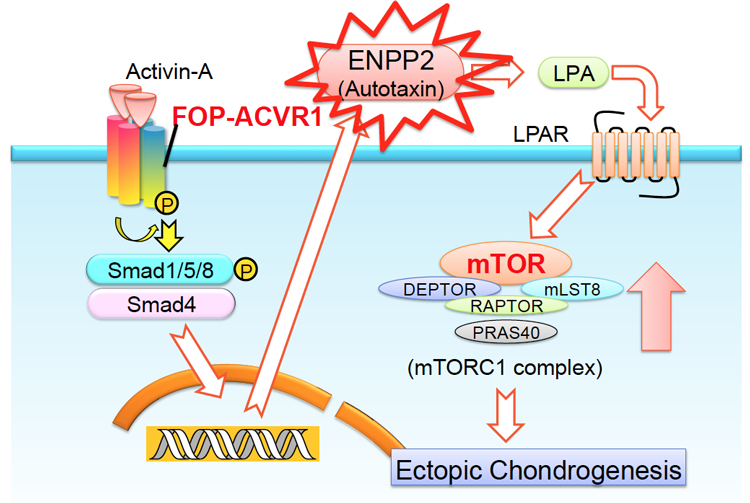
DNAマイクロアレイ解析を用いて、FOP-iMSCでの遺伝子発現量の変化を調べました。アクチビンAの刺激により発現量が大きく変化した遺伝子のうち、もともとの骨形成に関与しているBMP-7やTGFβ3により発現量が影響を受けていない70種の遺伝子(Fig. 3)に注目して、その発現量を調べたところ、ENPP2という遺伝子が最も大きく変動していました。ENPP2はmTORシグナルを活性化することが知られています。さらに、アクチビンAによって高まったmTORシグナルはENPP2阻害剤やRNA干渉により抑制されました。以上の結果から、アクチビンAによってFOP患者さんのACVR1が活性化され、ENPP2というタンパク質を介してmTORシグナルを活性化し、異所性骨を作らせるという分子メカニズムがわかりました(Fig. 4)。
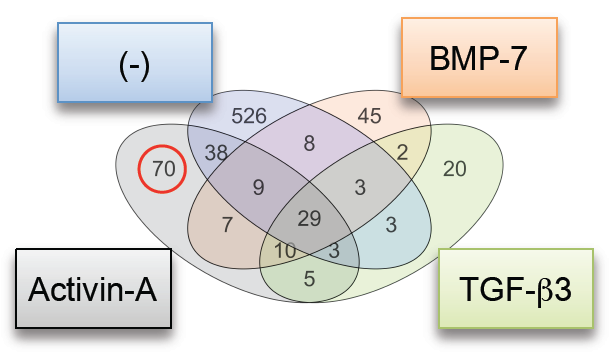
Activin-A: アクチビンAで刺激した場合
BMP-7: BMP-7で刺激した場合
TGF-β3: TGF-β3で刺激した場合
4.まとめ
今回の成果により、FOPにおける異所性骨化は、アクチビンAが変異型ACVR1に作用し、ENPP2というタンパク質が作られ、mTORのシグナルを活発にすることが原因であるという分子メカニズムが明らかになりました。また異所性骨化を抑える薬剤としてmTOR阻害剤であるラパマイシンが有効である可能性が示されました。
5.論文名と著者
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興機構 科学研究費補助金
- 文部科学省「再生医療の実現化プロジェクト」
- JST/AMED 「疾患特異的iPS細胞を活用した難病研究」
- JST/AMED 「iPS細胞研究中核拠点」
- AMED 「創薬基盤推進研究事業」
- iPS細胞研究基金
- JST 研究成果最適展開支援プログラム(A-STEP)
- AMED 「難治性疾患実用化研究事業」
7.用語説明
-
- 注1) アクチビンA
- TGF-β(Transforming Growth Factor β; トランスフォーミング増殖因子β)ファミリーに属するタンパク質で、細胞増殖や分化など多くの生理機能を調節する作用を持つ。
-
- 注2) BMP (Bone Morphogenetic Protein; 骨形成因子)
- 骨組織や軟骨組織の分化を誘導、促進するタンパク質。TGF-βスーパーファミリー注7)に属する。
-
- 注3) mTOR (mechanistic target of rapamycin)
- 免疫抑制剤ラパマイシンの標的分子として発見されたタンパク質。哺乳類などの動物で細胞内シグナル伝達に関与するタンパク質の一種。活性化するとタンパク質の合成を増加させたり、分解を抑制したり、細胞分裂などの調節に中心的な役割を果たすと考えられている。
-
- 注4) ラパマイシン
- 移植した臓器が拒絶される事を防ぐため等に使われている薬。免疫抑制機能を持っている。細胞内ではmTORの活性を阻害する効果がある。
-
- 注5) ACVR1 (Activin receptor type-1)
- BMP受容体の一部を構成するタンパク質で、BMPと結合することにより骨形成のシグナルを伝達する。アクチビンAとは、結合はするがシグナルは伝えないことが知られていた。FOP罹患者はACVR1遺伝子の変異により、ACVR1タンパク質の206番目のアルギニンがヒスチジンに変化し、アクチビンAとの結合で本来伝えないはずのBMPシグナルを伝えるということが、同グループの先行研究でわかっていた。
-
- 注6) ハイスループットスクリーニング
- 多数の化合物の中から有効な化合物を見つけるための手法。
-
- 注7) TGF-βスーパーファミリー
- TGF-β、BMP、アクチビンなど構造上類似した因子で構成される集合体の総称。スーパーファミリーには他に、免疫グロブリンスーパーファミリー、核ホルモン受容体スーパーファミリーなどが存在する。
報道関係者の皆さまからのお問い合わせ