Endeavors for Clinical Trials 治験に対する取り組み
「挑戦と創造」の姿勢
よりよい新薬を少しでも早く患者さんに役立てることができるように、早期承認取得に向けての取組み~グローバル臨床開発・国際共同試験の実施に必要な体制整備と標準化~を推進しています。一方、医薬品の開発過程においては多くの試練に遭遇しますが、「挑戦と創造」の姿勢を大切にして使命を達成し、「グローバルレベルで戦える研究開発型企業」を目指して活動を行っています。
より高い安全性を目指した開発体制
臨床試験では「予測できない副作用」のリスクがあることを常に念頭におき、患者さんの安全を最優先に考えた「良識と良心に基づく開発活動の推進」に取組んでいます。患者さんが治験に協力していただけるかどうかの判断に必要な情報をはじめ、治験実施中におけるあらゆる情報収集と報告、適正評価により、患者さんの安全性を確保しています。
また、治験薬の安全性プロファイルを開発段階で速やかに把握し、治験実施に際してより高い安全性確保に結びつける社内体制を整えています。
臨床試験のイメージ図
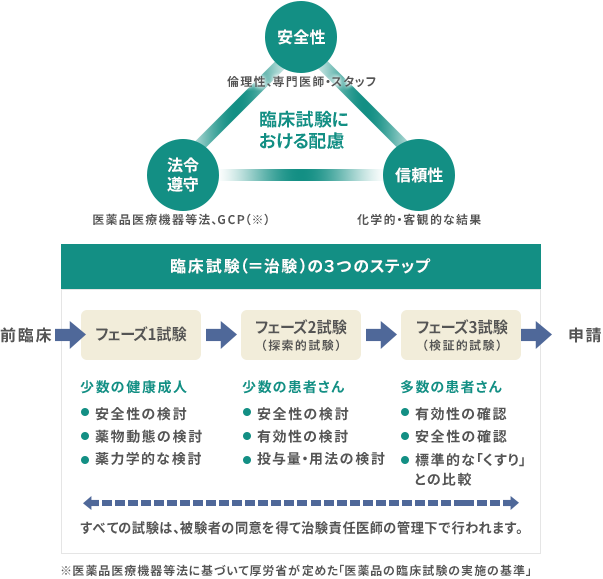
治験とは
いろいろな病気を治すためにたくさんの薬が使われています。すでに使われているこれらの薬は、国(厚生労働省)から「医薬品」として認められているものです。薬の候補として新しく開発された物質が「医薬品」として認められるために、健康な方や患者さんにご協力いただいて、その有効性(効き目)や安全性(副作用等)を調べる試験が行われます。健康な方や患者さんにご協力いただいて行う試験を「臨床試験」といい、薬の候補を用いて国(厚生労働省)の承認を得るために行われる臨床試験のことを「治験」といいます。
治験は「医薬品医療機器等法」という法律と、それに基づいて厚生労働省が定めた「医薬品の臨床試験の実施の基準」(GCPと呼ばれます)に従って、次のような手順で行われます。
- ①薬の候補を開発する製薬企業と専門家が協議して「治験の計画」を作成します。この計画は人権と安全性に配慮し、薬の候補を正しく評価するために作成されます。
- ②製薬企業から「治験の計画」の提出を受けた厚生労働省は、この計画が人権と安全性に配慮されているかを調べます。
- ③製薬企業から治験の実施を依頼された病院は、「治験の計画」が科学的に適切であるかどうか、そして治験に参加される方(患者さんなど)の人権や安全性に十分配慮されているかどうかを独立した委員会(「治験審査委員会」と呼ばれます)で審査します。
- ④治験を行う病院は、十分な設備が整い、専門の医師や薬剤師、看護師、治験コーディネーターなどのスタッフが揃っていることが必要です。
- ⑤治験を行う医師は、治験に参加される方に対して治験を開始する前に、治験の目的、方法、予想される効き目や現れるかもしれない副作用などについて説明しなければなりません。そして、自らの意思で参加を希望される方から「インフォームド・コンセント」を文書によって得なければなりません。
- ⑥治験に参加された方のプライバシーは法律で守られています。
- ⑦治験に参加された方に副作用が現れた場合は、必要な治療と適切な処置が行われます。
- ⑧治験によって得られた成績(効き目や副作用など)は製薬企業が取りまとめ、薬の候補が「医薬品」として国の承認を得るための資料になります。
「インフォームド・コンセント」とは
「インフォームド・コンセント」とは、患者さんが治療や診療(日常診療も含む)を受ける際に、「自分の病気のことやその治療方針について、医師などから十分に説明を受け、患者さん自身が説明の内容をよく理解し納得したうえで、患者さん自身の意思で治療を受けることに同意(承諾)する」という意味です。
治験におけるインフォームド・コンセント
- ①治験を行う医師が「治験の計画」に定められている基準に合う患者さんに、治験へのご協力をお願いします。
- ②患者さんに治験へのご協力をお願いする際に、医師は治験の目的、方法、予想される効き目や現れるかもしれない副作用などが書かれた「説明文書」を患者さんに手渡し、その内容を詳しく説明します。
- ③患者さんは「説明文書」を持ち帰り、ご家族などと十分相談し、治験のことをよく理解したうえで、治験に参加するか参加しないかを、患者さん自身の自由な意思で決めていただくことになります。
- ④参加する場合は、「同意文書」に自身で署名していただきます。