印刷(PDF/496KB)はこちらから 2009年08月26日 研究開発
統合失調症治療剤「ルラシドン」の第Ⅲ相試験(PEARL 2試験)結果について
大日本住友製薬株式会社(本社:大阪市、社長:多田 正世)は、グローバルで自社開発中の統合失調症治療剤「ルラシドン」の2本目の第Ⅲ相試験(PEARL 2試験)において、良好な結果を得ましたので、お知らせいたします。
本試験は急性期の統合失調症患者を対象とした6週間投与のプラセボ対照二重盲検比較試験であり、ルラシドン40mg/日および120mg/日の両投与群は、主要評価項目および主な副次評価項目において、プラセボ投与群に比べ有意に高い有効性を示しました。また、ルラシドン投与群はプラセボ投与群と同程度の中止脱落率であり、良好な忍容性を示し、体重や脂質への影響もプラセボ投与群と同程度でした。
PEARL 2試験の結果について、多田代表取締役社長は次のように述べています。「今回のPEARL 2試験のデータにより、当社はルラシドンが統合失調症における重要な治療薬となると強く確信しており、この結果に大変喜んでいます。当社は、米国FDA への新薬承認申請(NDA)を2010年初めに行う予定です。」
PEARL 2試験は、統合失調症治療におけるルラシドンの有効性と安全性を評価するため、全世界規模で2,000人以上の患者さんに参加いただいているPEARL (Program to Evaluate the Antipsychotic Response to Lurasidone) と名づけた第Ⅲ相試験プログラムの一つです。PEARL 2試験では、急性期の統合失調症の入院患者478人を、ルラシドン40mg/日、120mg/日、オランザピン15mg/日の固定用量とプラセボ群に分けて6週間投与しました。オランザピンは、分析感度を確認するための参照薬として用いました。
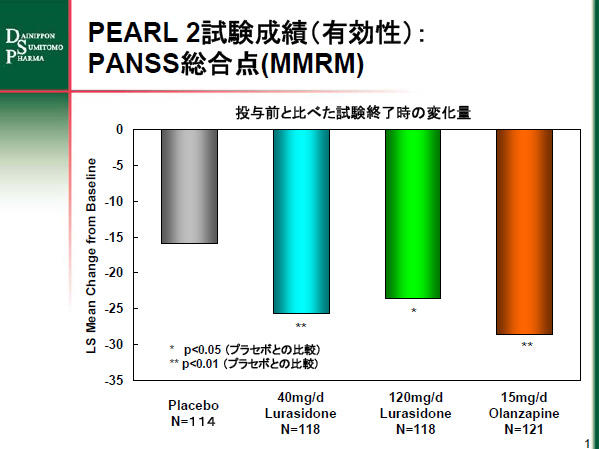
ルラシドン40mg/日投与群と120mg/日投与群(いずれも1日1回投与)は、試験終了時点における有効性の主要評価項目のPANSS (Positive and Negative Syndrome Scale) の総合点で、投与前と比べた試験終了時の変化量が、プラセボ投与群の-16.0に対し、40mg/日投与群で-25.7、120mg/日投与群で-23.6であり、プラセボ投与群に比較して有意に高い有効性を示しました。投与前後のPANSS の総合点で30%以上の改善が認められた患者の割合は、ルラシドン40mg/日投与群では53%、120mg/日投与群では47%、プラセボ投与群では38%でした。
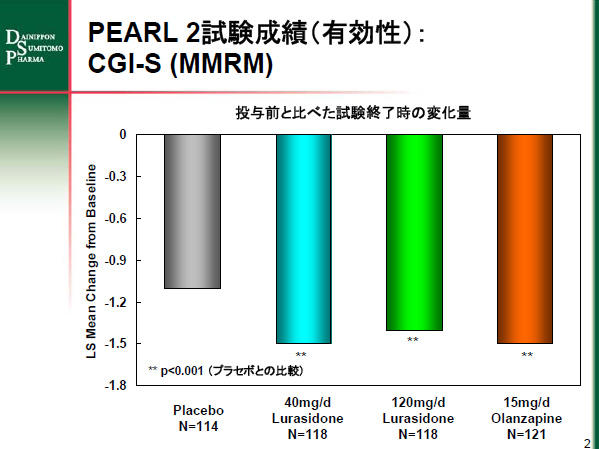
また、主な副次評価項目のCGI-S (Clinical Global Impressions Severity scale) においても、プラセボ投与群に比較して有意に高い有効性を示しました。投与前後における変化量ではプラセボ投与群の-1.1に対し、40mg/日投与群で-1.5、120mg/日投与群で-1.4でした。
PEARL 2試験の結果について、米国ヴァンダービルト大学医学部の精神医学薬学教授であり臨床治験医でもあるHerbert Meltzer(ハーバート・メルツァー)医師は、次のように評価しています。「統合失調症の患者さんやその介護者は、体重、脂質や運動障害に大きな影響を与えずに一貫した改善効果を示す新しい薬剤を必要としています。ルラシドンは統合失調症治療に非常に重要な新規薬剤になるでしょう。」
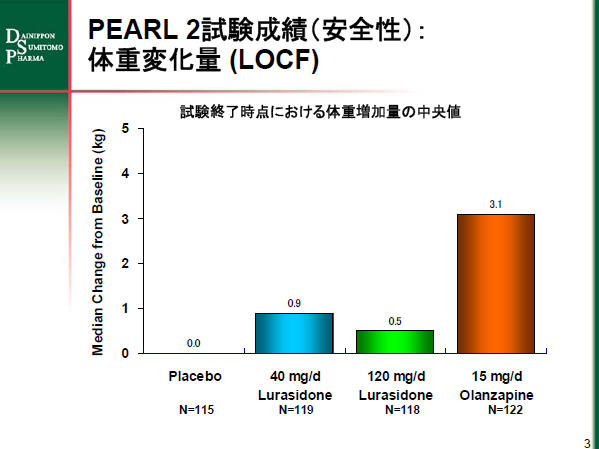
ルラシドン投与群の体重への影響はプラセボ投与群と同程度(試験終了時点における体重増加量の中央値は、ルラシドン40mg 投与群で0.9kg、120mg 投与群で0.5kg、プラセボ投与群は0kg)であり、臨床的に重要な体重増加(投与前後で7%以上の増加)の発現率は、40mg 投与群で7.6%、120mg 投与群で4.2%、プラセボ投与群で7.0%でした。
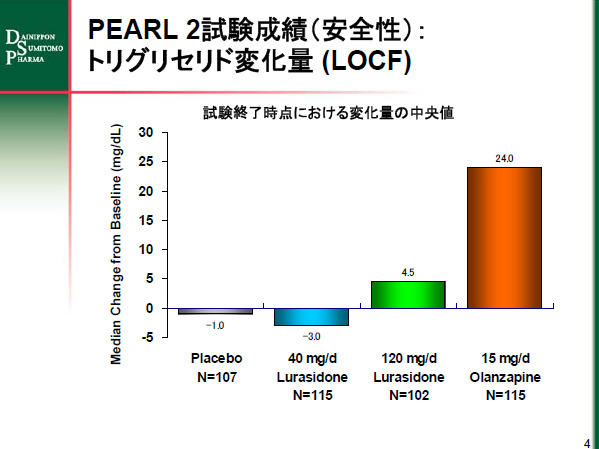
また、総コレステロール値やその他の脂質の変化量については、ルラシドンの両投与群はプラセボ群と同程度でした。すなわち、試験終了時点における総コレステロールの変化量の中央値は、ルラシドン40mg 投与群が-8.0mg/dl、120mg 投与群が-5.0mg/dl、プラセボ投与群が-5.0mg/dl でした。トリグリセリドでは、それぞれ-3.0mg/dl、4.5mg/dl、-1.0mg/dlでした。
ルラシドン投与群の中止脱落率(40%)は、プラセボ投与群(39%)とほぼ同程度で忍容性は良好であり、有害事象による中止脱落率は、ルラシドン群、プラセボ群共に9%でした。
また、PEARL 2試験における有害事象は概して軽度なものでした。ルラシドン投与群(L)において発現率が5%以上で、プラセボ投与群(P)の2倍以上認められたものは、アカシジア(L:17.3% vs P:0.9%)、傾眠傾向(12.2% vs 4.3%)、鎮静状態(11.4% vs 3.4%)、パーキンソン様症状(10.1% vs 1.7%)、悪心(9.3vs 4.3%)とジストニア(5.5% vs 0.9%)でした。
なお、オランザピン15mg/日投与群(O)でも、プラセボ投与群(P)に比べて有意に高い改善効果が認められました(PANSS 総合点:(O) -28.7vs (P) -16.0、CGI-S:(O) -1.5vs (P) -1.1)。
投与前後のPANSS 総合点で30%以上の改善を認めた患者の割合は、オランザピン15mg/日投与群では64%、プラセボ投与群では38%でした。
オランザピン投与群の患者では試験終了時点における体重増加量の中央値は3.1kg でした。臨床的に重要な体重増加(投与前後で7%以上の増加)の発現率はプラセボ群が7.0%に比べオランザピン群が34.4%でした。また、オランザピン群はプラセボ群と比べて脂質が大きく上昇しました(試験終了時点における変化量の中央値で、総コレステロール:(O)9.0mg/dl vs (P) -5.0mg/dl、トリグリセリド:(O) 24.0mg/dl vs (P) -1.0mg/dl)。また、オランザピン投与群に出現率が5%以上で、プラセボ投与群(P)の2倍以上認められた有害事象は、体重増加(O:20.5% vs P:5.2%)、鎮静状態(13.9% vs 3.4%)、口渇(9.8% vs 0.9%)、傾眠傾向(9.0% vs 4.3%)とアカシジア(7.4% vs 0.9%)でした。
当社の米国子会社である大日本住友製薬アメリカ(Dainippon Sumitomo Pharma America, Inc.)のAntony Loebel(アントニー・ローベル)臨床開発担当副社長は次のように述べています。「PEARL 2試験の結果はこれまで実施してきたプラセボ対照の試験の結果と一致しており、ルラシドンが統合失調症患者さんの治療において有効な薬剤となる可能性が強く示唆されました。」
なお、当社は、本試験の結果を年内の学会で発表できるように投稿しました。
以上
(ご参考)
【PEARL 2試験のデザインについて】
PEARL 2試験は、世界の52施設で実施した急性期統合失調症の入院患者を対象としたプラセボ対照無作為化二重盲検比較試験で、米国の25施設で286例、アジアの18施設で115例、南米5施設で48例、そして欧州4施設で29例の症例数でした。患者はDSM-IV 基準に基づいて診断された統合失調症患者のうちでPANSS 総合点数が80またはそれ以上の精神症状の急性増悪を示す患者を対象としました。患者の平均年齢は37.7歳であり、PANSS の投与前の平均スコアは96.6でした。統合失調症の罹病期間は平均13年以上であり、ほとんどが本試験に参加するまでに入院歴がありました。また、バイタルサイン、体重、心電図、運動障害評価(SAS,BAS,AIMS)および臨床検査値測定など安全性に関わる調査を実施しております。
【ルラシドンついて】
ルラシドンは、当社が創製し開発している独自な化学構造を有する非定型抗精神病薬です。ドパミン-2、セロトニン-7、セロトニン-2A、セロトニン-1A およびノルアドレナリン-α2c レセプターに高い親和性を示すという特徴的な受容体結合プロフィールを有しています。また、ルラシドンは、ヒスタミン-1とアセチルコリン-M1レセプターに対してはほとんど親和性を示しません。
【統合失調症ついて】
統合失調症は、慢性的に日常生活に支障をきたす深刻な疾病であり、米国だけで2百万から3百万人、世界中では2千4百万人以上が罹患しています。統合失調症は、男女の区別なく同様に発症し、世界的にその率に人種差はありません。統合失調症は治療可能な病状であり、環境要因と遺伝的要因の組み合わせにより発症すると考えられています。症状は、幻覚、妄想、思考障害、意欲低下、感情低下などの陽性、陰性症状だけでなく、記憶力、注意力または計画、体系付けあるいは決断する能力の障害、などの認知機能障害があります。米国における統合失調症治療にかかる総費用は2002年で$62.7billion であり、そのうちの直接の医療費は$22.7billion といわれています。
(注)オランザピンはイーライリリー社の製品です。
PEARL 2試験成績のグラフ
報道関係者の皆さまからのお問い合わせ