印刷(PDF/1MB)はこちらから 2022年03月01日 研究開発
ブタ腎臓移植は、胎仔腎臓の方が拒絶反応が弱い 〜サルを用いた世界初の証明〜
東京慈恵会医科大学 腎臓・高血圧内科 横尾隆教授らによる研究グループは、大日本住友製薬株式会社との共同研究で、ブタ腎臓の移植手術は胎仔の腎臓を用いることにより拒絶反応が弱くなることを世界で初めてサルを用いた実験により証明しました。
【ポイント】
・ブタ腎臓をサルに移植するには強力な免疫抑制を必要としますが、ブタ胎仔腎臓の場合は臨床に適用可能な免疫抑制でも生着しやすいことを証明しました。
・移植されたブタ胎仔腎臓がサルの体の中で育つ過程でホストであるサルの血管が入り込み生育することがわかりました。
・本成果はブタ胎仔腎臓を芽として患者体内で自己腎を再生させる胎生臓器補完法の臨床応用に繋がる技術的優位性を具体的に示すものです。
慢性腎不全に対する根本的な治療法はなく、腎臓機能を回復させる再生医療に大きな期待が掛かっています。東京慈恵会医科大学(所在地:東京都港区)は、2019年より国立研究開発法人 日本医療研究開発機構(以下「AMED」)の再生医療実用化研究事業(産学が連携して再生医療等製品の開発を目指す研究: 透析回避を目指したiPS細胞由来ハイブリッド腎芽による新世代腎不全治療法開発:研究開発代表 東京慈恵会医科大学 横尾 隆教授)の採択を受けて、大日本住友製薬株式会社(本社:大阪市中央区、以下「大日本住友製薬」)とヒトiPS細胞を用いた「胎生臓器補完法」(注1)による腎臓再生医療の実現を目標として、サルをレシピエントとして共同研究を進めてきました。学校法人 明治大学(所在地:東京都千代田区、以下「明治大学」)およびバイオス株式会社(所在地:東京都台東区、以下「バイオス」)も研究の推進に協力しています、「胎生臓器補完法」は、ブタ胎児の臓器を使用するため、昨今の遺伝子改変技術の進歩により遺伝子改変ブタの臓器をヒトに移植することで注目を集めている「異種移植」技術も利用しています。
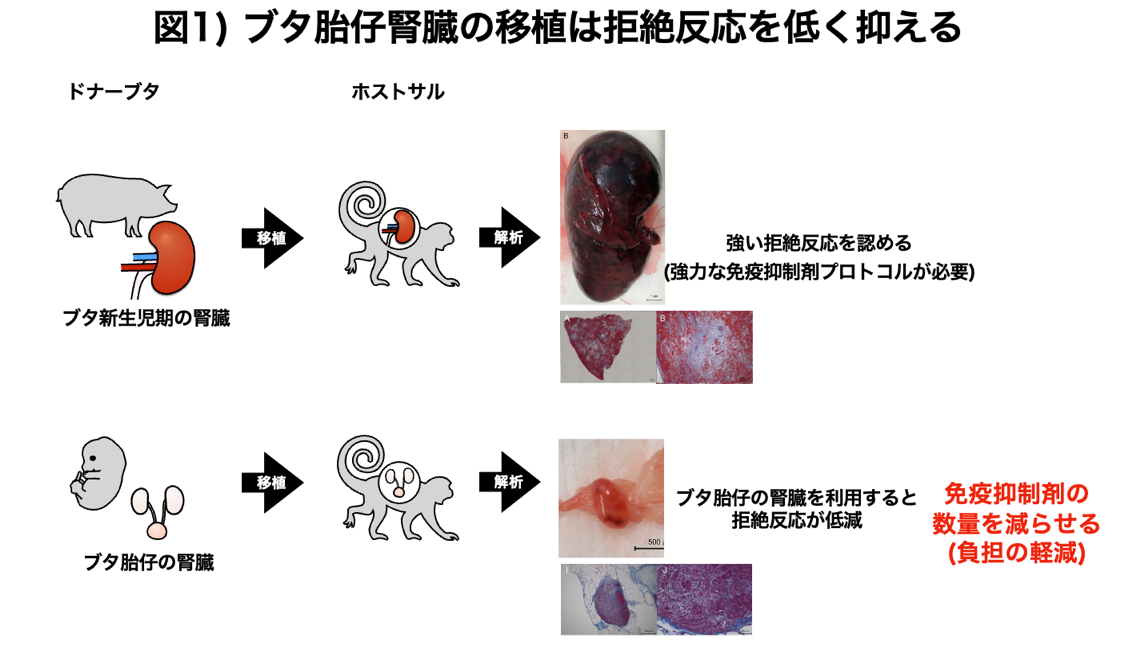
この度、ブタ腎臓のサルへの異種移植において、血管付きの異種移植法より、胎仔腎臓(注2)を移植して育てる異種再生法の方が、拒絶反応が弱いことを世界で初めてサルを用いて証明しました(図1)。本成果は、国際誌Engineeringで2月23日オンライン版で公開されました。
【研究の背景】
腎不全をはじめとする臓器不全の根本的対策として移植医療が進められ移植患者の劇的な改善が見込めるようになりました。しかし世界においても慢性的なドナー不足により一般的な治療法となっていないのが現状です。この危機的状況の打開策として、以前からブタを利用した異種移植が注目されていましたが、多くの免疫抑制剤管理を行ったとしても長期の維持は難しく利用可能な技術には至っていません。一方、完全にヒトiPS細胞から臓器を再生させる完全型の再生医療も生体で機能をもった実質臓器レベルのものはまだ出来ていません。
東京慈恵会医科大学 横尾 隆教授の研究グループは、世界でも独自な完全型再生医療と異種移植との利点を兼ね備えたキメラ臓器による「胎生臓器補完法」の研究を進めてきました。研究グループは、これまで遺伝子改変したマウス胎仔腎臓にラットの腎臓の前駆細胞注入した複合腎臓(クロアカ:膀胱付き腎原基)をラットに移植することで再生するキメラ腎臓を作りえることを証明してきました(山中, Nature Communications 2017)。これを受けて実際の臨床に応用すべく、大日本住友製薬とブタの胎仔腎臓をベースにサルに移植する前臨床研究をスタートさせました(2019年)。小動物モデルによるメカニズム研究に合わせ、サル等のヒトに近い実験動物での立証を行い、膀胱付き腎原基移植技術の開発を目指したものです。また、その基盤となるアカデミアの成果を実臨床にあげるためには産学連携が必要なところから東京慈恵会医科大学では産学連携講座 腎臓再生医学講座(バイオス社:林明男代表)を設置し、実験医学の世界的権威の小林英司博士を特任教授として招聘し本プロジェクトを推進してきました。
これまで胎仔の組織は移植において拒絶反応が出にくいとは言われていましたが、実際にブタの胎仔腎臓をサルへ移植しても生着ができ、さらに出生後の腎臓よりも免疫原性が低いかは不明でした。
※東京慈恵会医科大学および大日本住友製薬等による腎臓の再生医療実現に向けた取り組みの開始については、2019年4月5日付けのプレスリリースをご覧ください。
【研究成果の概要】
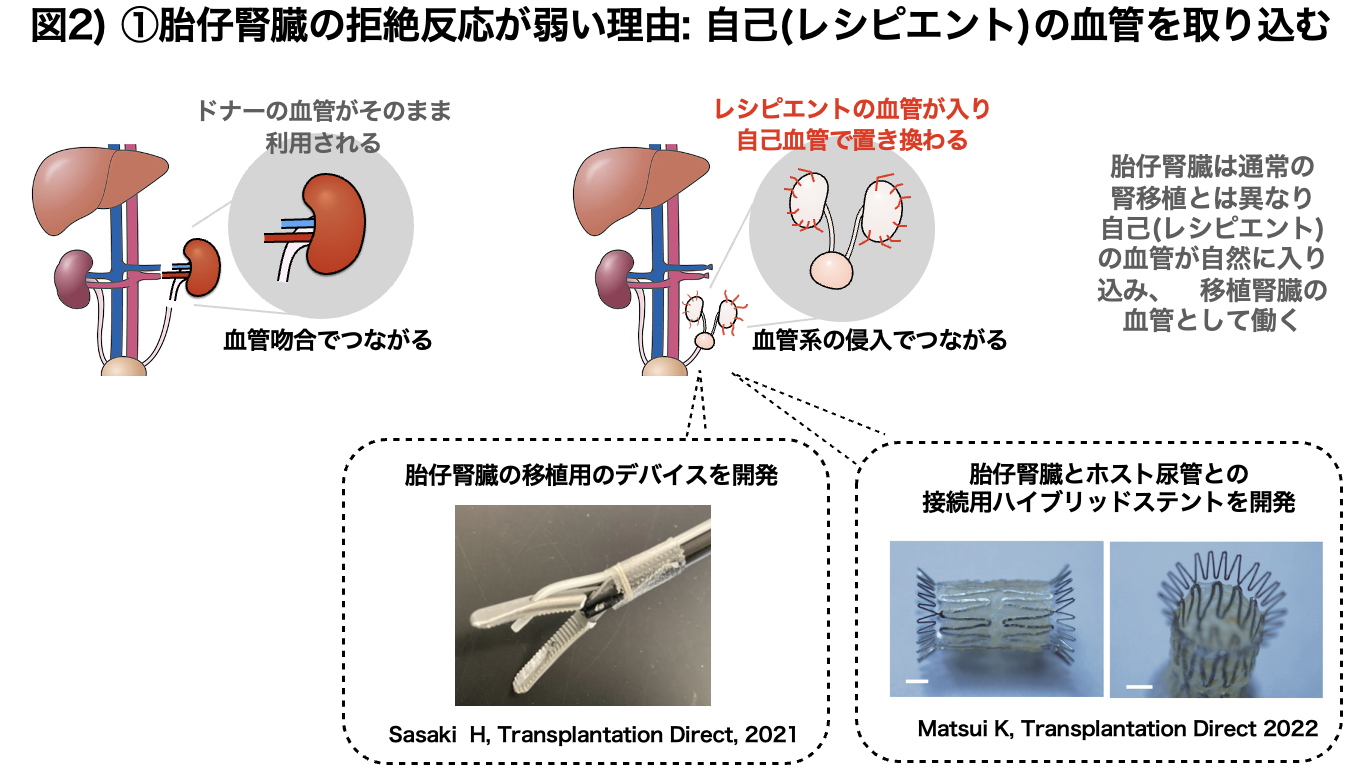
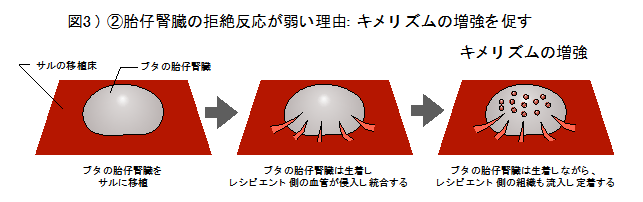
本研究では遺伝子改変を行っていない野生型ブタの胎仔腎臓と生後間もない新生仔腎臓を、臨床でも使用される免疫抑制剤のみを投与したサルに移植しました。胎仔腎臓は、2つの腎臓と尿管膀胱を含む複合腎臓(クロアカ:膀胱付き腎原基)を顕微鏡下で採取して、サルの腹部大動脈と尿管に近い後腹膜下にポケットを作り血管吻合をおこなわずにそのまま静置で移植しました(図2右)。一方、新生仔腎臓はサルの左側腎臓を摘出後、同所に血管や尿管ごと吻合し移植する方法を独自に開発し実施しました(高村, Acta Cirurgica Brasileira 2021)(図2左)。まず現在米国食品医薬品局(FDA)で臨床使用が承認されている免疫抑制剤を使用し、一匹のサルに2つの腎臓組織、すなわち、ブタ胎仔クロアカグラフトの静置移植と新生仔腎臓の血管吻合移植を行いました。結果、ブタの新生仔腎臓は約2週間後に拒絶反応による組織傷害が強く見られ、移植腎臓を摘出することでサルの死亡を食い止めました。一方、同時に移植されていた胎仔腎臓は、同一のサル体内で2カ月以上も大きな拒絶反応を起こすことなく糸球体や尿細管などが発育しました。胎仔クロアカグラフトの免疫反応の弱さを再度検証するために臨床使用される免疫抑制剤を長期間使用しながらその生着を経時的に観察しましたが、移植されたブタの胎仔腎臓は徐々に発育を続けました。病理像ではレシピエントであるサルの血管が入り込んでおり(図2)、さらにレシピエントの組織と一部キメラ化することも確認され(図3)、胎仔腎臓移植の免疫拒絶の低減が実証されました。
【研究成果の意義】
本研究結果は、ブタ胎仔の腎臓原器移植は霊長類での拒絶反応が現在臨床使用される免疫抑制剤でコントロールできることを示したものです。これまで異種移植は、移植されるドナーブタの多重遺伝子改変で進められてきていますが、従来の異種移植とは異なる方法によるサルでの前臨床試験を成功させた意義は大きいと考えられます。
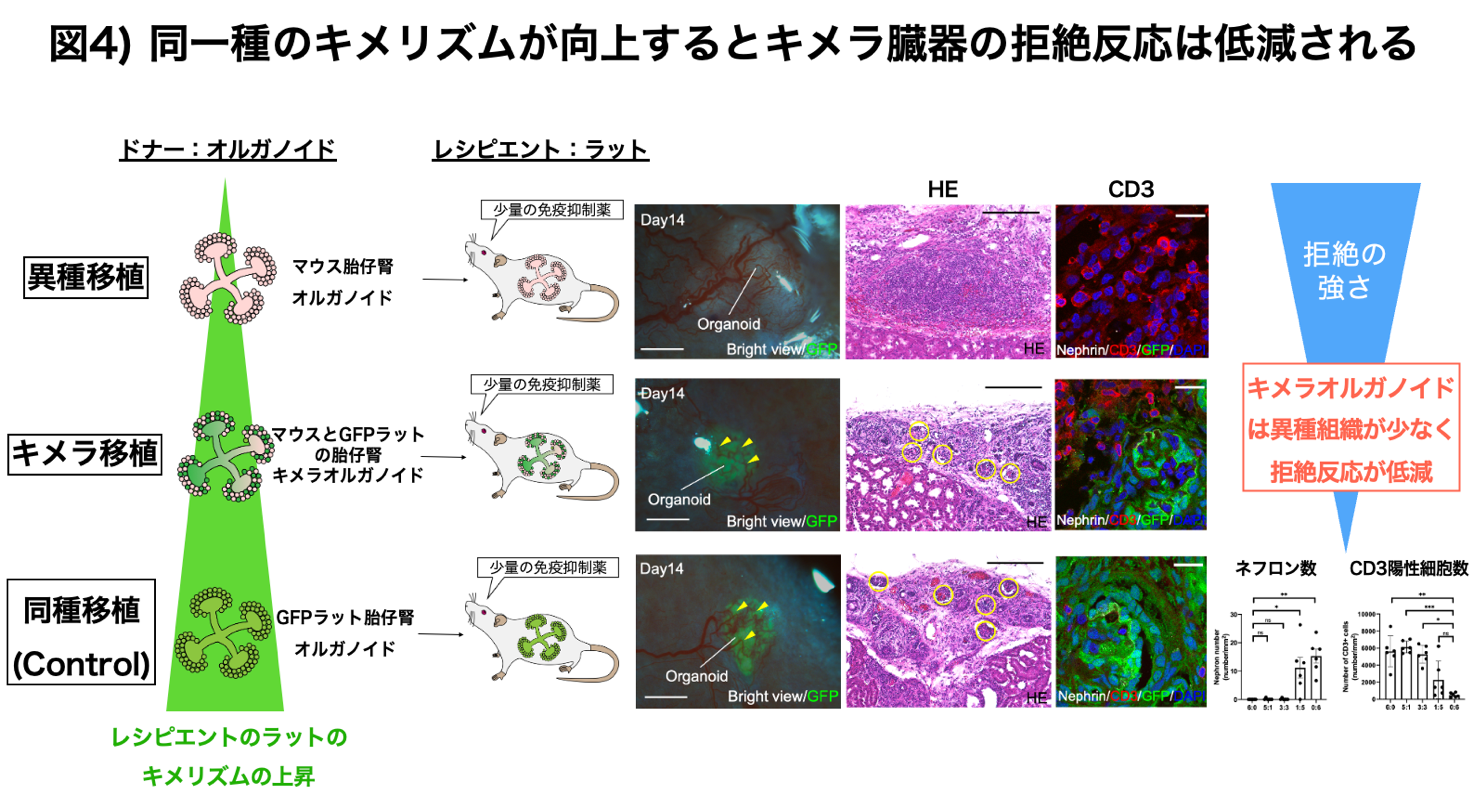
研究グループは、マウス―ラット間の小動物間の実験ではありますが、レシピエント(ラット)と同じ動物種の腎臓の構成成分(キメリズム)を高めたラットとマウスによるキメラ腎オルガノイド移植は、マウス単独の腎オルガノイドによる異種移植と比較しCD3陽性炎症細胞の浸潤とそれに伴う糸球体廃絶も軽度であり、キメラが異種の免疫拒絶反応を著明に低減できることを実験的に証明しました(齋藤, Frontiers in Immunology 2022)(図4)。
さらに研究グループは、柔らかいブタ胎仔腎臓原器を腹腔鏡で安全に移植できるデバイス開発(佐々木 Transplantation Direct 2021)(図2左下)や、移植し発育した膀胱とホストの尿管をつなぐハイブリッドステント(松井 Transplantatoin Direct 2022)(図2右下)の開発に成功しており、ヒト臨床で行うための準備を進めています。
【課題と克服戦略】
今回、遺伝子改変をしていない通常のブタの胎仔腎臓をサルに「異種移植」できることを示しましたが、依然として多くの免疫抑制剤の投与が必要でした。研究グループ独自の完全型再生医療と異種移植との利点を兼ね備えたキメラ臓器による「胎生臓器補完法」は、ブタ胎仔腎臓が患者の体内で育ちながら患者本人の腎前駆細胞がブタ胎仔腎臓の組織を置き換えることで免疫抑制剤を必要としなくなることを目指しています。患者本人の腎前駆細胞を利用するための課題は、患者由来のiPS細胞から迅速に腎前駆細胞を作る技術であり、ブタ胎児腎臓の後者組織を置き換えるための課題は、薬剤によるブタ組織が消失する遺伝子改変ブタの作製です。研究グループはいずれの課題にもすでに共同研究を遂行中です。
【特記事項】
本研究は、以下の支援を受けて実施されました。
国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業
研究開発代表者:横尾 隆
【用語解説】
(注1)胎生臓器補完法
臓器形成期には各臓器に特化した前駆細胞が集まり、自己増殖と相互作用による分化を繰り返し、実質臓器を形成する。臓器形成期の発生領域内に存在する前駆細胞を、ゲノム編集技術を駆使して薬剤投与によって除去できるようにしたマウスを用い、ドナー前駆細胞の移植と共にホスト胎仔側の除去を行うことで、完全にドナー細胞に置き換わった組織をもつキメラ臓器の生成に成功した。この胎生臓器補完法はネフロン前駆細胞を標的とすることでキメラ腎臓を生成し機能をもった腎臓の再生を示した。
(注2)胎仔腎臓
哺乳類の胎仔は発生中に前腎、中腎、後腎を持つが、生まれるときにもつ腎臓(永久腎)は後腎から分化している。後腎は未熟だが、生体に移植することで成熟腎臓まで成長(分化)できるようになる。
以上
報道関係者の皆さまからのお問い合わせ