印刷(PDF/299KB)はこちらから 2021年10月11日 医薬品
小児先天性無胸腺症の免疫再構築を適応症とした再生医療に使用される 「RETHYMIC」の米国における承認取得について
大日本住友製薬株式会社(本社:大阪市、代表取締役社長:野村 博)の連結子会社であるエンジバント・セラピューティクス・リミテッドは、他家培養胸腺組織である「RETHYMIC®(リサイミック)」(販売名、以下「本剤」)について、米国食品医薬品局(FDA)より、米国において最初で唯一の小児先天性無胸腺症の免疫再構築を適応症として承認を取得したことを、2021年10月8日(現地時間)に発表しましたので、お知らせします。本剤は、生涯に1回きりの再生医療に使用されます。
小児先天性無胸腺症は極めて希な疾患であり、米国での毎年の推定患者数は約17~24人です。小児先天性無胸腺症は、生まれつき胸腺が欠損しているため、深刻な免疫不全、生命を脅かす免疫調節不全および易感染性を引き起こします。小児先天性無胸腺症の治療は、支持療法しかなく、通常、2歳または3歳までに亡くなります。
エンジバント社のCEOであるRachelle Jacques(ラシェル・ジャック)は次のように述べています。「小児先天性無胸腺症の患者さんのご家族は、あまりにも長い間、支持療法のみによる治療では悲しい結末に終わるという現実に直面してきました。FDAによる本剤の承認により、臨床試験だけではなく、本剤を切実に必要としている患者さんに提供することができます。臨床試験に参加してくださった105人の患者さんとそのご家族、そしてこの先駆的な再生医療研究プログラムに貢献してくださったすべての方々に深く感謝します」
本剤の臨床試験の治験責任医師であり、デューク大学医学部の小児科および免疫学の教授であるLouise Markert(ルイーズ・マーカート)医師は次のように述べています。「本剤は、以前はほとんど希望が持てなかった患者さんの生存期間を延長させることを目的とした25年以上の研究の成果です。私たちは、生命の危機にある小児先天性無胸腺症の患者さんが、FDAが承認した治療法によって生存できるように、日々の研究プログラムに意欲的に取り組んできました」
エンジバント社はこのたびの承認取得により、希少小児疾患プログラムに基づき、FDA から優先審査バウチャー(Priority Review Voucher)を取得しました。
*本件の詳細についてはエンジバント社のプレスリリースをご覧ください。
(https://enzyvant.com/enzyvant-receives-fda-approval-for-rethymic-allogeneic-processed-thymus-tissue-agdc-a-one-time-regenerative-tissue-based-therapy-for-pediatric-congenital-athymia/)
(ご参考)
リサイミックの臨床試験データについて
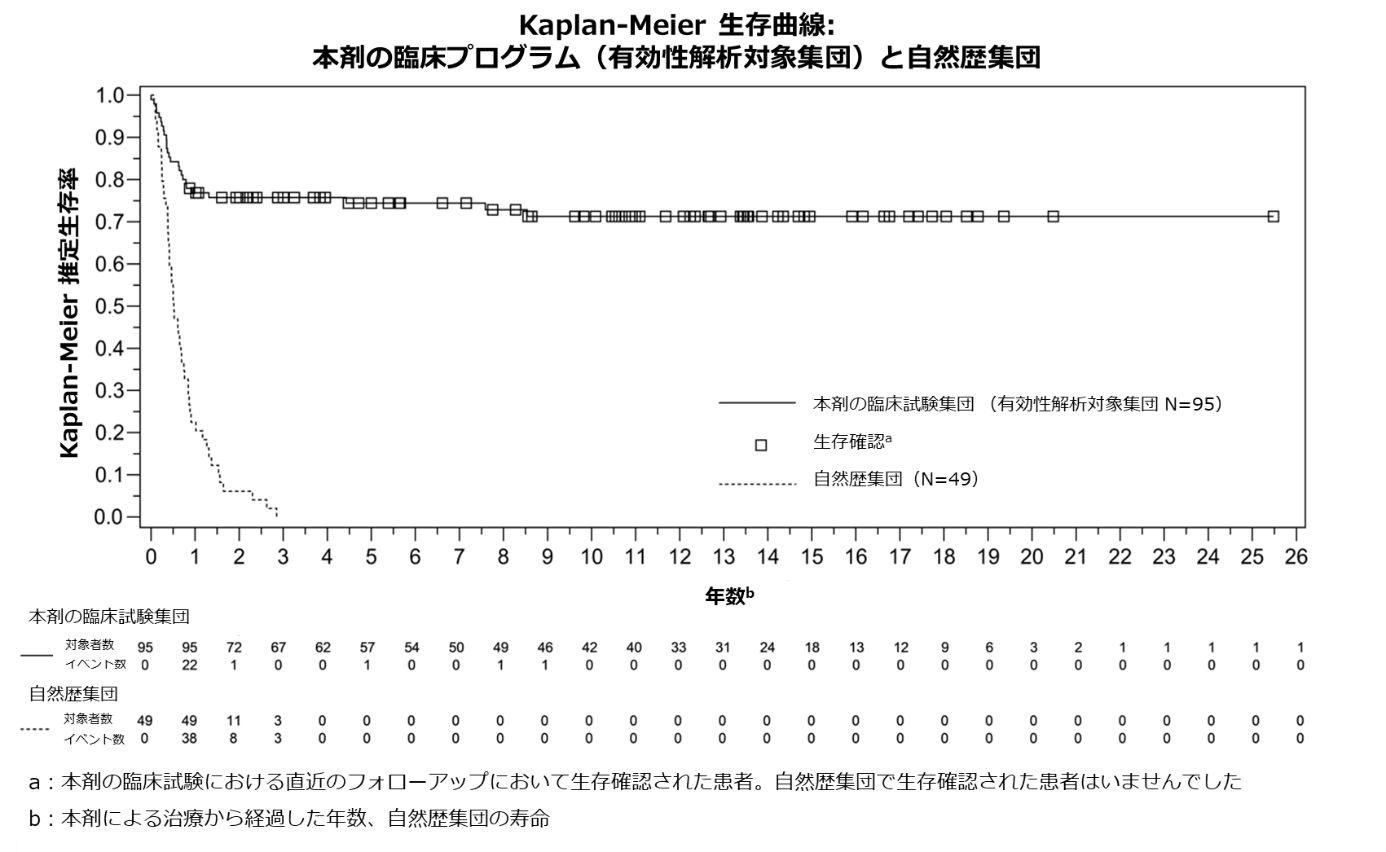
本剤の臨床試験データは、1993年から2020年までに患者が登録された10の前向き単群非盲検試験を基に形成されており、105人の患者の累計797人年のデータおよび最長25.5年間の生存観察データが含まれています。治験審査委員会(IRB)が承認した10のプロトコールがあり、それぞれに従って、105人の患者が本剤の外科的移植を受け、有効性解析対象集団は95人、安全性解析対象集団は105人でした。生存率の観察期間は最長25.5年で、有効性解析対象集団では、Kaplan-Meier推定生存率(95%信頼区間)は1年で77%(0.670-0.841)、2年で76%(0.658-0.832)でした。移植1年後に生存していた患者を対象とした場合、生存率の観察期間の中央値である10.7年時点で、Kaplan-Meier推定長期生存率は94%でした。臨床試験中、本剤移植後6、12および24カ月に患者のナイーブT細胞のレベルを、フローサイトメトリーを使用して測定しました。臨床試験に参加した患者のナイーブT細胞は、臨床試験開始時は非常に少ない状態でしたが、ナイーブCD4+T細胞およびナイーブCD8+T細胞は、1年目で再構築が開始され、2年目まで持続的に増加しました。本剤は、移植後2年間、時間の経過とともに感染症の罹患数を統計学的に有意に減少(p<0.001)させました。
胸腺および小児先天性無胸腺症について
T細胞の「T」は胸腺(Thymus)を表し、胸腺は、有害な病原体を排除するT細胞を選択したり、有害な病原体に代わってヒトの体を攻撃する可能性があるT細胞を細胞死させたりする働きを持つ器官です。小児先天性無胸腺症は、生まれつき胸腺が欠損している極めて希な疾患であり、深刻な免疫不全、生命を脅かす免疫調節不全および易感染性を引き起こします。小児先天性無胸腺症の患者は、支持療法のみでは、通常、2歳または3歳までに亡くなります。
先天性無胸腺症の患者は、米国の全50州で新生児に対し義務付けられているSCID(重症複合免疫不全症)スクリーニングにおいて、T細胞の欠如により発見されます。SCIDと先天性無胸腺症はともに原発性免疫不全症ですが、異なる症状を呈します。小児先天性無胸腺症は極めて希な疾患であり、米国での毎年の推定患者数は17~24人です。
リサイミックについて
リサイミック(他家培養胸腺組織)は、小児先天性無胸腺症の免疫再構築を適応症とした生涯に1回きりの革新的な組織移植による再生医療に使用されます。小児先天性無胸腺症患者の胸腺機能を再生するように設計・処理されたヒト胸腺組織であり、提供者と被移植者のマッチングを必要としません。本剤は、10の臨床試験で25年以上にわたって研究されており、FDAより再生医療先端治療指定(RMAT)、ブレイクスルーセラピー指定、希少小児疾患治療薬指定、希少疾患治療薬指定などの複数の指定を受け、欧州医薬品庁(EMA)より希少疾患治療薬指定および先端医療医薬品指定(ATMP)を受けています。本剤は、小児先天性無胸腺症の免疫再構築を適応症としてFDAによって承認された最初で唯一の治療法です。
エンジバント社について
エンジバント社は、深刻な希少疾患をもつ人々のために斬新で革新的な再生医療の開発に取り組むバイオ医薬品企業です。エンジバント社のリサイミック(開発コード:RVT-802)は、極めて希で生命を脅かす小児免疫不全疾患である小児先天性無胸腺症の免疫再構築を適応症としてFDAにより承認されており、生涯に1回きりの組織移植による再生医療に使用されます。
当社はRoivant Sciences Ltd.(本社:英国 ロンドン・スイス バーゼル)との戦略的提携により、新設子会社であるスミトバント社の傘下に 2019 年12月にエンジバント社を完全子会社化しました。エンジバント社に関する詳細は、https://enzyvant.com/をご覧ください。
優先審査バウチャー(Priority Review Voucher)について
優先審査バウチャーは、製薬企業が今後の承認申請の際に、 FDAの優先審査指定にすることができる権利で、当該医薬品候補物質の審査期間短縮および迅速承認に繋がる可能性があります。優先審査バウチャーは、希少疾患に対する新薬開発を促すことを目的にFDAが発行しています。
以上
報道関係者の皆さまからのお問い合わせ