印刷(PDF/2MB)はこちらから 2022年01月21日 研究開発
機能性の高い移植用網膜組織の開発 -遺伝子改変ヒトES細胞を用いた未熟網膜組織の移植-
理化学研究所(理研)生命機能科学研究センター網膜再生医療研究開発プロジェクトの万代道子副プロジェクトリーダー(理研創薬・医療技術基盤プログラムプロジェクトリーダー)、山﨑優客員研究員(研究当時、現大日本住友製薬株式会社再生・細胞医薬神戸センター主任研究員)、大日本住友製薬株式会社再生・細胞医薬神戸センターの桑原篤グループマネージャーらの共同研究チーム※は、特定の遺伝子を欠失させたヒトES細胞[1]から網膜組織を分化誘導して移植に用いることにより、理想に近い生着を可能にする網膜組織を作製できることを明らかにしました。本研究成果は、「網膜変性疾患[2]」に対する再生医療において、臨床応用可能な網膜組織の作製を実現すると期待できます。
末期の網膜変性疾患に対する治療として、iPS細胞[1]やES細胞などの多能性幹細胞[1]から分化誘導した視細胞[3]を移植する再生医療に期待が寄せられています。網膜では、視細胞や双極細胞[3]、神経節細胞[3]などの神経細胞が層を形成しており、移植治療においては、層構造を有する網膜組織の移植が安定した生着・成熟に有利であるとされています。一方、移植網膜組織の中に双極細胞が含まれていると、移植側の視細胞と宿主側の双極細胞のシナプス[4]形成が阻害され、網膜の視機能再生効率を悪くする場合があることが示唆されていました。
今回、共同研究チームは、双極細胞の分化に関わるIslet-1遺伝子[5]を欠失したヒトES細胞から分化誘導した網膜組織を、未熟な段階で末期網膜変性のモデルラットに移植しました。その結果、移植後に成熟した網膜では、対照群(野生株)に比べて移植側(ヒト)の双極細胞が減少するとともに宿主側(ラット)の双極細胞が移植視細胞とシナプスを形成し、光刺激が宿主の神経節細胞に効率よく伝わる機能的な再生を確認しました。
本研究は、科学雑誌『iScience』(1月21日号)の掲載に先立ち、オンライン版(2021年12月20日付)に掲載されました。
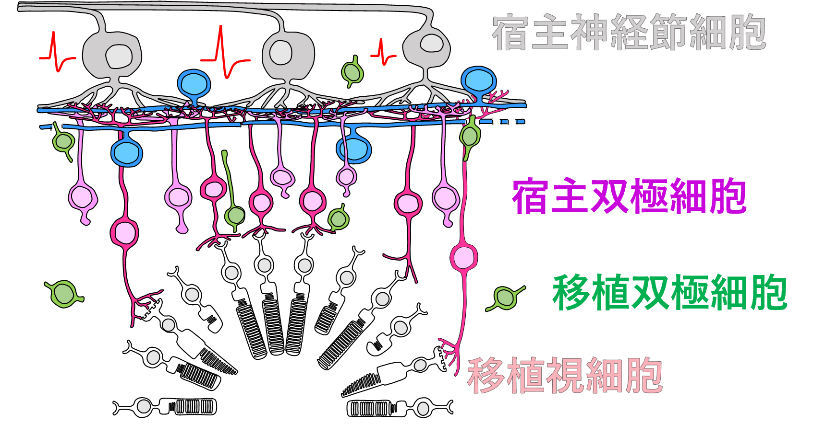
宿主双極細胞(ラット)と移植視細胞(ヒト)の機能的な接続
※共同研究チーム
| 理化学研究所 生命機能科学研究センター 網膜再生医療研究開発プロジェクト | ||
| 客員研究員(研究当時) | 山﨑 優 | (やまさき すぐる) |
| (現 大日本住友製薬株式会社 再生・細胞医薬神戸センター 主任研究員) | ||
| 研究員(研究当時) | トゥ・ホンヤー | (Tu Hung-Ya) |
| 客員研究員 | 松山 オジョス 武 | (まつやま おじょす たけし) |
| 客員技師(研究当時) | 堀内 茉莉 | (ほりうち まつり) |
| (現 大日本住友製薬株式会社 再生・細胞医薬神戸センター 研究員) | ||
| 技師(研究当時) | 橋口 朋代 | (はしぐち ともよ) |
| 客員技師 | 庄 隼生 | (しょう じゅんき) |
| 客員主管研究員 | 髙橋 政代 | (たかはし まさよ) |
| 副プロジェクトリーダー | 万代 道子 | (まんだい みちこ) |
| (理研 創薬・医療技術基盤プログラム プロジェクトリーダー) | ||
| 大日本住友製薬株式会社 再生・細胞医薬神戸センター | ||
| グループマネージャー | 桑原 篤 | (くわはら あつし) |
| センター長(研究当時) | 岸野 晶祥 | (きしの あきよし) |
| 取締役 再生・細胞医薬担当 | 木村 徹 | (きむら とおる) |
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、創薬・医療技術基盤プログラム)で実施し、日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「視機能再生のための複合組織形成技術開発および臨床応用推進拠点(研究開発分担者:万代道子)」、および大日本住友製薬株式会社の支援を受けて行われました。
1.背景
網膜は、光を感じて伝達する複数種の神経細胞(ニューロン)と、それを支える網膜色素上皮細胞で構成された複雑な組織です(図1)。眼に入ってきた光の刺激は、まず一次ニューロンである視細胞(桿体視細胞[3]と錐体視細胞[3])が受容し、電気信号に変換されます。この電気信号は二次ニューロンの双極細胞に伝達され、三次ニューロンの神経節細胞を介して脳に届けられます。これらの細胞はそれぞれが層を形成し、網膜は全体として多層構造となっています。
「網膜変性疾患」は遺伝子の異常により、まず桿体視細胞が正常な機能を失い変性することで減少し、進行すると中心視野を担う錐体視細胞も徐々に減少し、視力低下や失明に至ります。一度視細胞が失われてしまうと、既存の手法では治療できません。そこで、多能性幹細胞から網膜の細胞や組織を分化誘導して移植する再生医療に期待が寄せられています。
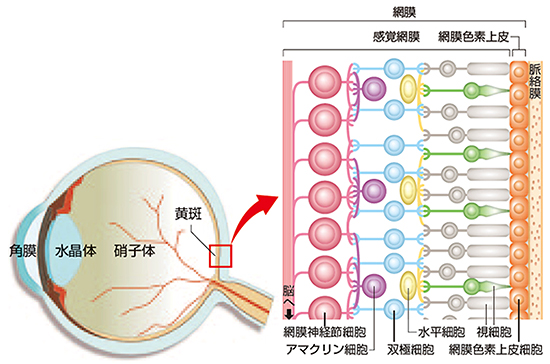
図1 眼球と網膜の基本構造
網膜は大きく分けて視細胞(桿体視細胞と錐体視細胞)、水平細胞、双極細胞、アマクリン細胞、(網膜)神経節細胞の5種類の神経細胞から成る感覚網膜と、それを支える網膜色素上皮から構成される。光が眼球の角膜、水晶体、硝子体を通って感覚網膜に達すると、視細胞で電気信号に変換される。電気信号は双極細胞を介して神経節細胞から脳に伝えられ、視覚情報として処理される。(『RIKEN NEWS』2014年7月号より転載)
視機能の再生医療のための移植手法には、網膜組織を分散して視細胞のみ純化した液体(細胞懸濁液)を移植する方法と、理研などのグループが開発した網膜シート(網膜組織)を移植する方法注1、2)の二つがあります。細胞懸濁液移植は、視細胞が移植先の双極細胞と直接接触するためシナプスが形成されやすいという利点が考えられますが、形態的な成熟や長期の生着は難しいとされています。
これに対して万代道子副プロジェクトリーダーらは、胎生期に相当する未熟な網膜シートを移植すると、視細胞が移植先で層構造を形成しながら成熟し、安定的に長期間にわたって生着することや、免疫原性[6]が低いことなどの利点があることを報告してきました注2-5)。一方で、移植網膜の中に残存する双極細胞が移植視細胞と宿主双極細胞とのシナプス形成を阻み、網膜シートの視機能再生効果を最大化できていない可能性が示されています。
治療法として細胞懸濁液移植と網膜シート移植のどちらが適切であるかは、疾患の進行状態などでも左右されるため、それぞれの利点を生かしつつ課題を克服する技術の開発が重要です。
万代副プロジェクトリーダーらの理研の研究チームは、先行研究において、双極細胞の運命づけや成熟に関与するIslet-1などの遺伝子を欠失したマウスES細胞やマウスiPS細胞を用いた移植実験を行いました。その結果、遺伝子を欠失させた移植後網膜は、成熟すると対照群(野生株)と比べて移植組織由来の双極細胞が減少し、宿主双極細胞と移植視細胞のシナプス形成が促進され、末期網膜変性モデルマウスの視機能がより効率よく改善できる可能性が示されました注6)。今回、共同研究チームはこれをさらに発展させ、ヒトのES細胞で双極細胞の形成に関わるIslet-1遺伝子を欠失させることにより、より機能性の高い網膜組織を作製できるかを検証しました。
2.研究手法と成果
共同研究チームはまず、Islet-1遺伝子を欠失させたヒトES細胞の網膜組織への分化誘導を試みました注7、8)。すると、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織は、培養初期においてはIslet-1遺伝子の発現が見られないこと以外、Islet-1遺伝子を持つヒトES細胞(野生株)由来の網膜組織と変わりない形態を示しましたが、長期培養後(分化後240日)に双極細胞が減少することを確認しました(図2左・中)。
そこで、分化後60日(ヒト胎生期60日目の網膜に相当)の未熟なIslet-1遺伝子欠失ヒトES細胞由来の網膜組織を、視細胞がほとんど消失している末期網膜変性モデルラットに移植しました(図2右)。移植時点では、Islet-1遺伝子欠失ヒトES細胞由来と、Islet-1遺伝子を持つヒトES細胞(野生株)由来の移植網膜に形態的な違いはほとんどありませんでした。しかし移植後、分化が始まってから200日を超え、組織が成熟すると、Islet-1遺伝子欠失ヒトES細胞由来網膜では明らかな双極細胞の減少が見られました(図2右)。
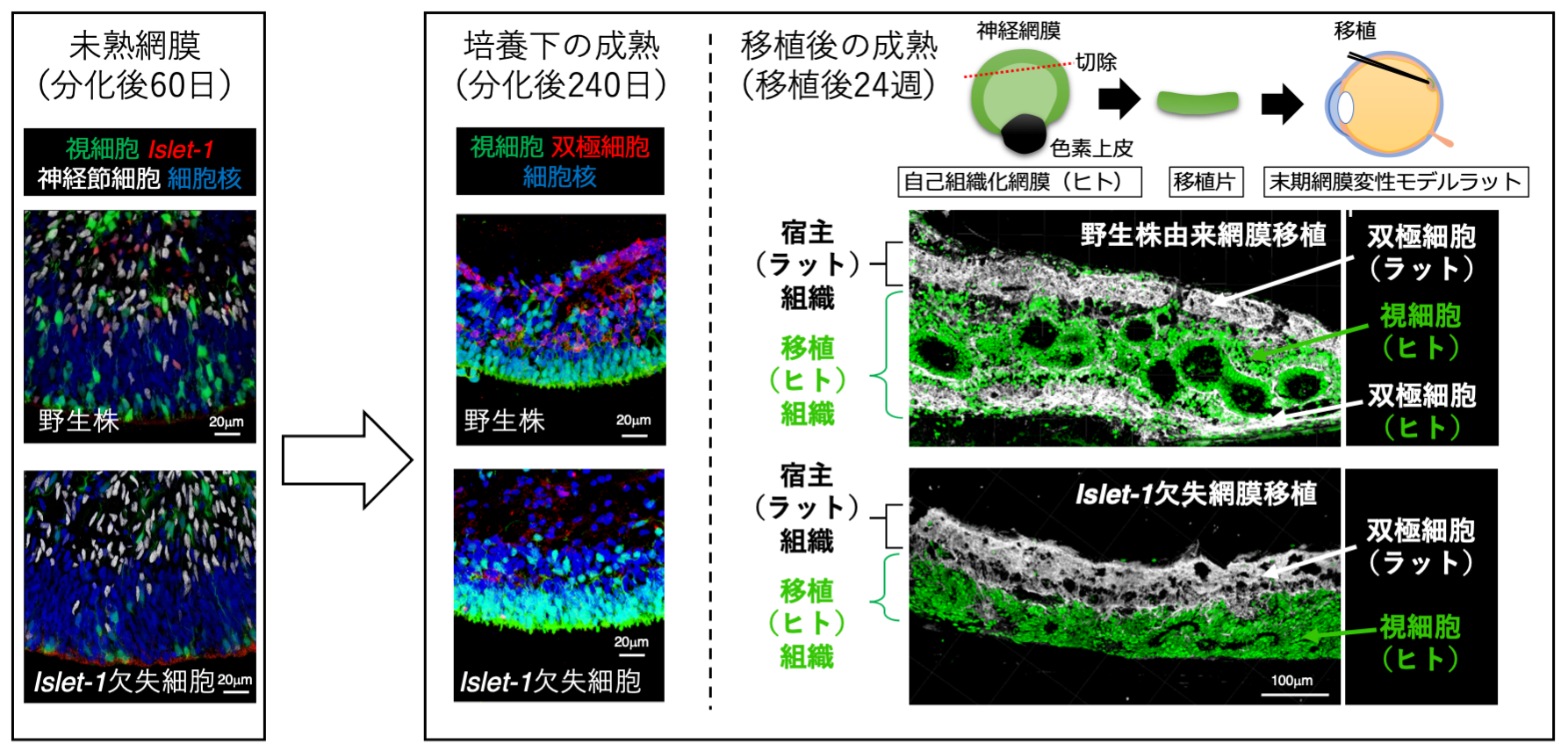
図2 遺伝子改変ヒトES細胞から分化誘導した網膜組織のラットへの移植
また、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織移植では、宿主双極細胞の軸索が移植視細胞に突起を伸ばしている様子が見られ、この突起の末端を詳細に調べると、移植視細胞の前シナプスマーカー[4]と宿主双極細胞側の後シナプスマーカーの共局在が観察されました。これらの結果は、移植した網膜組織中の双極細胞が減少し、移植視細胞と宿主双極細胞との間で機能的なシナプスが形成されやすくなったことを示しています(図3)。
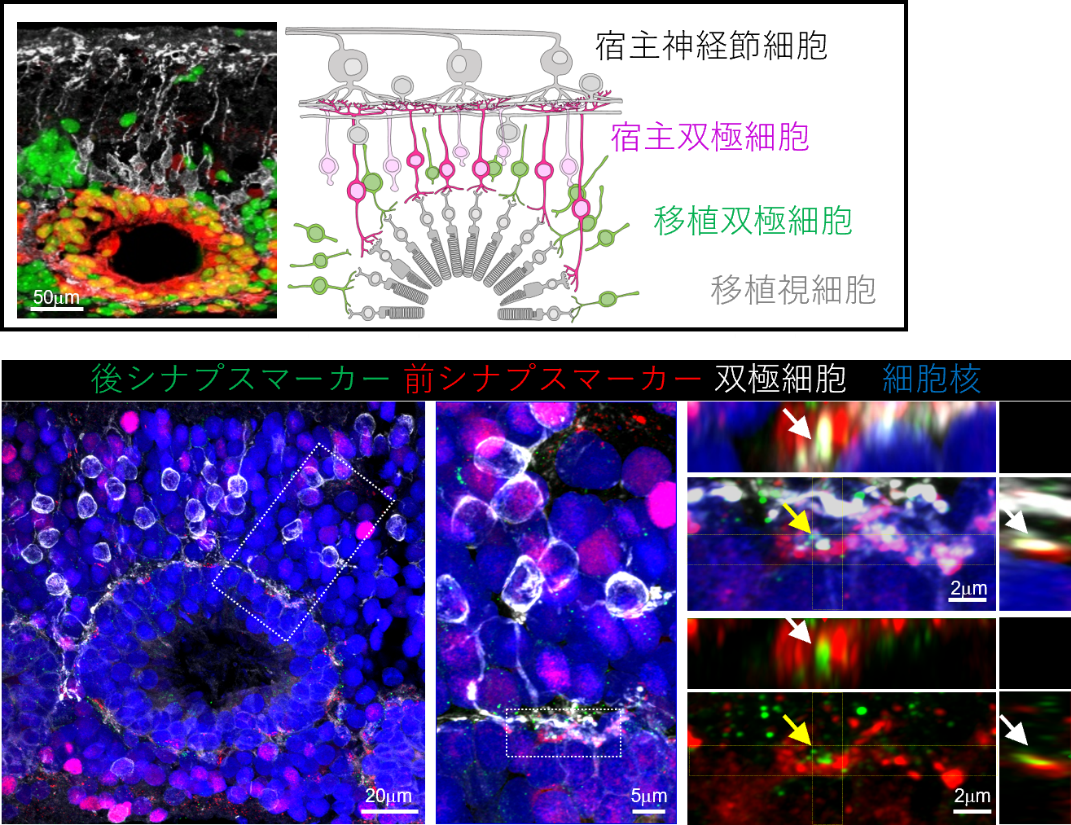
図3 移植視細胞と宿主双極細胞のシナプス形成
次に、Islet-1遺伝子の欠失が視機能の再生につながるかを検証するため、宿主の神経節細胞の光応答を調べました。多電極アレイシステム[7]と呼ばれる手法で電気生理学的な解析を行ったところ、移植視細胞に当てた光に対する宿主の神経節細胞の反応率は、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織移植が最も高く、次いでIslet-1遺伝子を持つヒトES細胞(野生株)由来の網膜移植、移植なしの網膜、という結果になりました(図4)。また、光反応率の高い網膜組織の組織学的特徴を調べたところ、移植視細胞と宿主双極細胞の接触率の高さや、網膜の内層構造の維持が光反応率と相関していました(図5)。これらは、Islet-1遺伝子欠失ヒトES細胞由来の網膜組織を移植した場合の特徴であり、機能的な優位性とも関係していることが示されました。
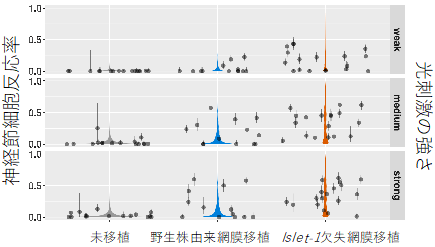
図4 移植視細胞への光刺激に反応する宿主の神経節細胞
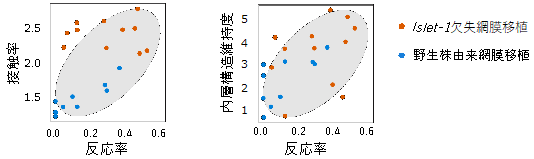
図5 宿主の神経節細胞の光刺激に対する反応率と相関する移植網膜の特徴
以上の結果から、胎生期相当の未熟な網膜組織を移植する従来の方法に加え、双極細胞の形成に関わる遺伝子を欠失した多能性幹細胞を用いるという二つの工夫により、移植後の網膜細胞の分化を制御し、最終的により理想に近い網膜組織として生着させられることが分かりました(図6)。
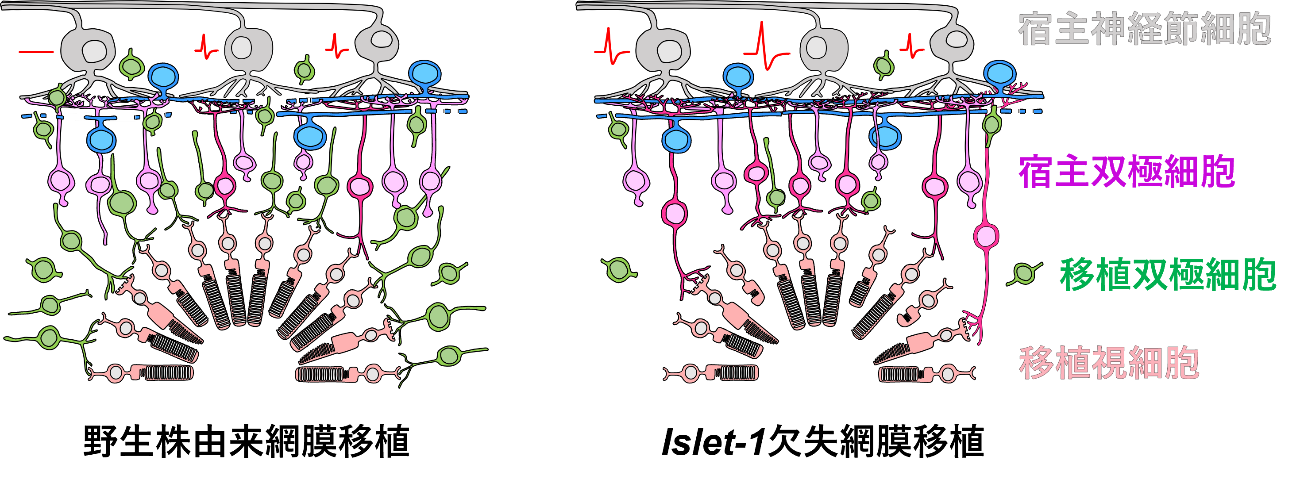
図6 本研究で実証した理想に近い網膜組織の再生
3.今後の期待
これまで、理研や神戸市立神戸アイセンター病院など、国内の研究グループは、網膜変性疾患に対する再生医療の臨床研究として、滲出型加齢黄斑変性[2]に対する自家iPS細胞由来網膜色素上皮シートの移植(2014年)注9)および他家iPS細胞由来網膜色素上皮細胞懸濁液の移植(2017年)注10)、網膜色素上皮不全症[8]に対する他家iPS細胞由来網膜色素上皮細胞懸濁液移植(2021年)注11)を行ってきました。また、神戸市立神戸アイセンター病院は、網膜色素変性[2]に対し、大日本住友製薬が製造した他家iPS細胞由来網膜シート(網膜組織)の移植(2020年)を行いました注12)。これらはいずれも、正常な遺伝子型を持つヒトiPS細胞を用いて、治療法の安全性や有用性の検証のために実施されたものです。
本研究では、移植に用いるヒト多能性幹細胞を遺伝子改変することで、より機能性の高い網膜組織を作製できることを示しました。今後、この技術をさらに発展させ、臨床応用可能な網膜組織移植法の確立を目指します。
4.論文情報
<タイトル>
A Genetic modification that reduces ON-bipolar cells in hESC-derived retinas enhances functional integration after transplantation
<著者名>
Suguru Yamasaki, Hung-Ya Tu, Take Matsuyama, Matsuri Horiuchi, Tomoyo Hashiguchi, Junki Sho, Atsushi Kuwahara, Akiyoshi Kishino, Toru Kimura, Masayo Takahashi, Michiko Mandai
<雑誌>
iScience
<DOI>
10.1016/j.isci.2021.103657
5.補足説明
報道関係者の皆さまからのお問い合わせ