

治験
薬ができるまでの、長い道のり Vol.3

いよいよ長い道のりも、“終わりの始まり”です。非臨床試験で絞り込んだ薬の候補となる化合物(以下「候補化合物」)の有効性や安全性を、ヒトで試験します。ヒトを対象に行う試験全般を「臨床試験」といいますが、薬としての承認を得るために行う臨床試験は、「治験(ちけん)」と呼びます。
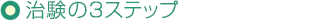
治験は大きく3段階に分かれます。いきなり病気の患者さんを対象に試験するのではなく、まずは少数の健康な人、次に少数の患者さん、最後に多数の患者さんを対象に行います。これらをそれぞれ「第Ⅰ相試験」、「第Ⅱ相試験」、「第Ⅲ相試験」と呼びます。

だから第Ⅲ相試験は、多くの場合このように試験をします。まず多数の患者さんを、コンピュータを使ってランダムに2つのグループに分けます。一方には開発中の薬を、もう一方には、その病気の治療のために広く使われている薬、または何の薬効もないプラセボ(偽薬)を使います。そして一定期間様子を見て、開発中の薬のほうが有効性が高いか、安全に使えるかなどを検討します。

ここで大切なのは、患者さん自身も、患者さんの様子を調べる医師らも、誰がどちらの薬を使っているのか分からないようにしてある、ということです。
先に知らせてしまうと、たとえば開発中の薬を使っている患者さんに「これを使えば元気になるはず」という思い込みがあれば、本当に体調が良くなることがあります。医師らも「この患者さんは開発中の薬を使っているな。だから元気になったんだ」などと判断してしまうかもしれません。これをプラセボが招く思い込みによる効果、「プラセボ効果」と呼びます。

誰がどちらの薬を使ったか。それは試験が終わるまで、誰も開けてはならない“封筒”の中に秘められています。
そして「この患者さんは、このくらい良くなった」「この患者さんには、こんな副作用が出た」という結果を集計してから、秘密の封筒の封を切り、本当に開発中の薬のほうが有効か、安全か、といったことを検討します。患者さんと医師ら、双方が“目隠し”した状態で試験をするこの方法を「二重盲検試験(にじゅうもうけんしけん)」と呼びます。

新しい薬を世に出すために、治験は不可欠なステップであり、患者さんの協力なしには治験を行うことはできません。ですから患者さんには、医師が文書を使って丁寧に時間をかけて説明をしなくてはならないことになっています。また、試験への参加を拒否しても、いったん参加してから途中でやめてしまっても、患者さんには何ら不利益がないことも約束されます。
これらのことを理解し、同意書にサインした患者さんのみが治験に参加できます。この「十分な説明を受けたうえでの同意」を「インフォームド・コンセント」と呼びます。
患者さんが安心して試験に参加できるように、治験を行う病院は、以下のような条件を満たしてなくてはなりません。
・試験を行うための医療設備が十分に
整っている。
・緊急の場合、ただちに必要な治療や
措置が行える。
・責任をもって治験を行う医師、看護師、
薬剤師などがそろっている。
(参考:厚生労働省:医療品の臨床試験の実施の基準に関する省令 第54条)

治験を経て、有効性や安全性が十分に確認されたら、製薬会社は厚生労働省に製造、販売を認めてもらうための「承認申請」を行います。そのために必要な資料が膨大な量で、すべてプリントアウトしたら「トラック1台分」にもなるとか。厚生労働省の依頼で専門機関が審査、協議を行い、承認となれば、“長い道のり”のゴール。新薬の誕生です。

「ドラッグ」は薬、「ラグ」は遅れ、ずれ。ドラッグ・ラグとは、ある国で使われている薬が、別の国でも使えるようになるまでに生じる時間差のことだよ。
海外ではすでに多くの患者さんに使われていて、よく効いているようだし、安全性も問題なさそうっていう薬でも、日本で使うためにはあらためて日本で審査して、承認されないといけないんだ。
2006年には、たとえば米国で使えるようになった薬が日本でも使えるようになるまでに、2.4年のラグがあったよ。※1効果が期待できる薬を1日でも早く試したい患者さんにしてみれば、この差は大きいよね。
ドラッグ・ラグを解消するために、いろんな国が合同で行う治験に日本も積極的に参加したり、治験を行う病院同士のネットワークを強化して効率よく治験を行ったり、承認のための審査を行う審査員を増やしたり……といった取り組みが行われているんだ。その結果、2019年には、日米間のドラッグ・ラグは0.6年にまで縮まったんだって。※2

※1 独立行政法人医薬品医療機器総合機構 ドラッグ・ラグの試算(平成18年~平成21年度)
※2 独立行政法人医薬品医療機器総合機構 ドラッグ・ラグの試算(平成27年~令和元年度)


新薬の誕生は、基礎研究から製造・販売の承認という「創薬」のゴールであると同時に「育薬」の始まりです。育薬とは、承認された薬が、多くの患者さんに実際に使われるようになってから得られた情報をもとに、薬のより適正な使い方を検討し、改良や次なる新薬の開発へと生かしていくことを指します。
発売後の薬は、年齢や性別、体質や症状の重さも異なる、さまざまな患者さんが使います。別の薬を一緒に使うこともあるでしょう。すると、創薬の段階では分からなかった薬の作用や副作用が、初めて分かってくることもあります。たとえば腎臓の病気がある患者さんだけに強く現れる副作用があるとか、逆に治験の段階では分からなかった良い作用が見つかることも。
医師や薬剤師は、個々の患者さんの薬の効き目や副作用の有無を観察します。製薬会社は、副作用のことはもちろん、有効性や安全性に関する調査(製造販売後調査)を行うなど、販売する薬に関するあらゆる情報を集めます。製薬会社はこれらの情報を随時評価し、必要な対策を行います。たとえば医師に「こういう副作用が起きることがあるので、定期的に検査をして注意して下さい」と伝えます。副作用に関する情報収集などは、薬が販売されている限り行われます。
このような情報収集・評価を経て、「もっと飲み込みやすい薬が欲しい」といった患者さんの要望がかなえられたり、より副作用が少ないタイプへと改良されたり、はたまた、別の症状にも効く薬として使われるようになったり。多くの患者さんの協力のもと、薬は育ち続けるのです。


監修:加藤哲太(日本くすり教育研究所代表)