Corporate Regulatory Compliance and Quality Assurance 信頼性保証
当社では患者さんや医療関係者に安心して医薬品をご使用いただくために、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下「医薬品医療機器等法」)」はもとより、GLP※1、GCP※2、GMP※3、GQP※4、GVP※5、GPSP※6、GDP※7などに関する各省令・ガイドラインなどを遵守し、研究~開発~市販後における各業務の信頼性担保のための監査を実施し、信頼性保証体制の維持・向上に努めています。また、患者さんや医療関係者などから寄せられる情報を収集、一元管理し、適正使用に関する情報提供を通じて問題を未然に防ぐことで、予測、予防型のプロアクティブな活動を推進しています。
- ※1GLP(Good Laboratory Practice):医薬品の安全性に関する非臨床試験の実施の基準
- ※2GCP(Good Clinical Practice):医薬品の臨床試験の実施の基準
- ※3GMP(Good Manufacturing Practice):医薬品及び医薬部外品の製造管理及び品質管理の基準
- ※4GQP(Good Quality Practice):医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準
- ※5GVP(Good Vigilance Practice):医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準
- ※6GPSP(Good Post-marketing Study Practice):医薬品の製造販売後の調査及び試験の実施の基準
- ※7GDP(Good Distribution Practice):医薬品の適正流通の基準
信頼性保証体制

品質保証、薬事における適切性とデータインテグリティの確保
製薬企業にとって、研究データや生産データ等のインテグリティ(完全性、一貫性、正確性)の確保は、医薬品の信頼性の根拠となるため極めて重要です。データの記録・検証・承認・保管のシステム化、適切な内部統制体制の確立と運用を実施しています。
薬害の発生防止
当社はクロロキンおよびサリドマイド薬害事件の当事会社です。
クロロキン製剤は、日本では1950年代から70年代にかけて約20年間にわたり販売されており、当時の住友化学株式会社と稲畑産業株式会社も、製造、販売していました。クロロキンは抗マラリア剤でしたが、日本では科学的裏付けに乏しい適応範囲の拡大(腎炎、慢性関節リウマチ、気管支喘息、てんかん)によりクロロキンが長期投与され、クロロキン網膜症の被害者が拡大しました。
サリドマイド薬害は、当時の大日本製薬が催眠・鎮静剤として発売したサリドマイド剤を妊婦が服用することにより、サリドマイド胎芽病という手、耳、内臓などに先天性の障がいを受けた子どもたちが多数出生した薬害です。1974年に国および当社は因果関係と責任を認めることを前提として、被害者との間で和解のための「確認書」に調印しました。この「確認書」に基づき、国および当社は被害者家族全員に損害賠償金を支払うとともに、サリドマイド被害者福祉センターを通じて各種の福祉政策を実施しています。
また、当社では「二度と薬害を起こさない」という気持ちを従業員全員に根付かせるため、毎年全従業員を対象にした薬害研修および安全性情報収集手順の研修を継続的に実施しています。
グローバルに「安心」を届ける品質保証体制の確立
医薬品の製造にあたっては、高度な品質を確保するために各国でGMPが厳格に定められています。当社グループは日本、米国、中国等で新薬を開発し、各国規制当局(厚生労働省、FDA(米国食品医薬品局)、EMA(欧州医薬品庁)、TGA(豪州医薬品管理庁)など)の厳しい審査と承認を得て、製品をお届けしています。さらに、製品は、海外提携企業の監査、ICH(医薬品規制調和国際会議)のガイドラインをはじめとした、グローバルレベルの厳しい品質基準もクリアする高い設備設計水準や品質保証体制で製造されています。
当社グループでは、世界各国の患者さんや医療関係者に「安心」して使用いただける製品をお届けするため、グループ会社に適用するグローバルな品質ポリシー※8を設定し、グローバル信頼性保証体制のもとで高品質な製品の提供に取り組んでいます。
- ※8住友ファーマグループ企業のグローバル品質ポリシーは、SMP GROUP QUALITY POLICY をご覧ください。
また、医薬品の品質をサプライチェーン全体にわたって保証するために、各国すべての製造や包装等の委託先に対して指導や管理監督を行っています。このような品質保証活動は開発段階から製造販売後まで当社グループが一体となった体制下で実行しています。
品質情報システムによる問い合わせへの迅速な対応
国内では、医療機関からの品質に関する問い合わせに迅速に応えることを目的として、品質情報システムを構築し、GQPのもとで運用しています。
品質情報システムに医療機関からの問い合わせが入力されると、その医薬品を製造した工場で速やかに同一ロットの保管品の調査、製造記録書の調査、現品の品質確認、発生原因調査などを実施し、必要に応じて再発防止策を立案・実施します。
このシステムには、品質保証部門、営業部門、生産部門、安全管理部門のメンバーがアクセスでき、クレーム対応や情報共有などを迅速に行うことができます。さらに、情報検索機能を駆使して製品や期間ごとの問い合わせの発生傾向を解析することにより、同種事例の発生予防にも効果を上げるとともに、MR(医薬情報担当者)が持つタブレット端末で問い合わせの多い案件に対する基本回答を閲覧できるようにしたことで、より迅速な問い合わせへの対応が可能になりました。
ファーマコビジランス(医薬品安全性監視)における安全性情報の一元管理とタイムリーな安全対策の実施
開発段階から製造販売後まで安全性情報を一元管理
医薬品が製造販売承認を受けて市販され、多くの患者さんにさまざまな状況のもとで使用されるようになると、開発段階では予測できなかった副作用などが明らかになることがあります。このため、開発の初期段階から集積された安全性情報に加え、製造販売後も医療機関、提携会社等から幅広く情報を収集します。
国内外で収集された安全性情報はグローバルデータベースで一元管理して評価し、医薬品の安全性確保、適正使用のために必要な対策を立案し、タイムリーな安全対策の実施につなげています。このような活動は、医薬品医療機器等法やGVPを遵守して実施します。承認時には医薬品リスク管理計画書(RMP)を策定し、これに基づく医薬品安全性監視活動の一環として、必要に応じて、GPSPを遵守した製造販売後調査を実施します。
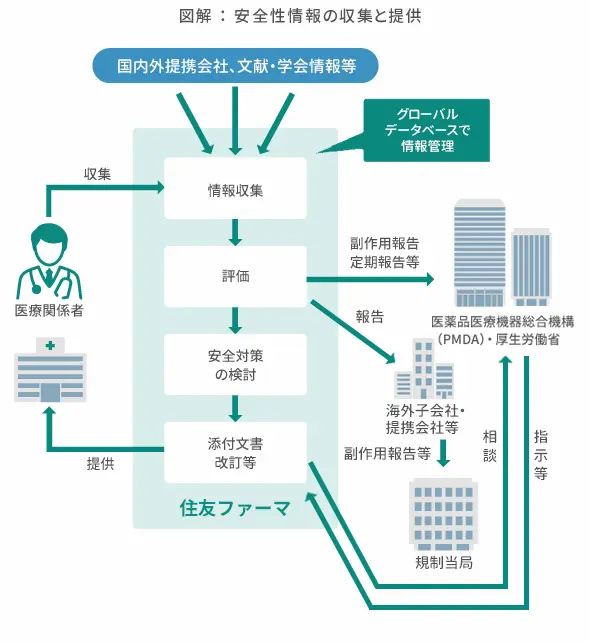
当社グループでは、世界各国の患者さんや医療関係者に製品を「安心」してご使用いただけるよう、グループ会社に適用するグローバルな安全性ポリシー※9を設定し、グローバル信頼性保証体制のもとで適正にご使用いただくための安全性情報の提供に取り組んでいます。
- ※9住友ファーマグループ企業のグローバル安全性ポリシーは、SMP GROUP SAFETY POLICY をご覧ください。
適切な情報提供による適正使用の推進
適正使用のためのわかりやすい情報の提供
医薬品は適正に使用することで効果が発揮される一方で、使用方法を誤ると効果がないばかりか好ましくない作用の発現につながってしまいます。
当社では、医薬品の効果が患者さんにより安全に発揮されるよう、適正使用情報を的確かつ迅速に医療現場に提供しています。例えば、電子化された添付文書に新たな副作用等の注意を追記する場合、処方する医師や薬剤師の先生方に対し、MRや当社医療関係者向けウェブサイト、DSU(医薬品安全対策情報)等を通じて迅速に情報提供しています。また、RMPをはじめ、当社製品を医療関係者に適正にご使用頂くための資材や、くすりのしおりや患者向医薬品ガイドなど、医療関係者が患者さんに薬の服用方法や副作用の具体的な症状などを説明するための資材を作成し、MRや当社ウェブサイト等を通じて情報提供しています。
これからも当社ウェブサイトなどを活用し、患者さんやご家族、医療現場のニーズに応え、わかりやすい情報を提供・発信していきます。
製品情報検索システム
当社は、ウェブサイトでの情報提供に加え、社内製品情報検索システムを使い、医療関係者からの問い合わせに対し、MRやくすり情報センターからの迅速かつ的確な当社製品の情報提供に努めています。医療関係者のニーズをふまえた内容の見直しやコンテンツの充実を図り、情報の信頼性の向上と顧客満足につながる情報提供に努めていきます。
「情報のハブ(中核)」として顧客の声のさらなる活用を推進
当社製品に関連した問い合わせ窓口として、「くすり情報センター」を設け、患者さんやそのご家族、医療関係者からの問い合わせに対応しています。今後も迅速・的確・丁寧に適正使用情報を提供することにより、患者さんの健康に寄与していくとともに、問い合わせ対応により得た顧客の声を分析し、社内に適切にフィードバックし、顧客の声のトレンドを見える化するなど、改善につなげる役割を強化していきます。
2024年度(2024年4月1日~2025年3月31日)の問い合わせ総数は、約21,700件でした。
くすり情報センターへの問い合わせ総数等の詳細な情報は「ESGデータ一覧」をご覧ください。
患者さんが求める新薬の創出
当社は、グローバルに存在感のある研究開発型企業として、アンメット・メディカル・ニーズ(医療関係者や患者さんにとって十分に満たされていない医療ニーズ)の高い領域での革新的で有用な医薬品の創出を目指しています。
「研究開発」の詳細については、「研究開発」をご覧ください。
「未承認薬・適応外薬の開発要望への対応」については、「医薬品アクセス向上の取組」をご覧ください。
当社にとって、当社製品を使用される患者さんの安全の確保は最優先事項です。開発段階において、患者さんのニーズに応じた剤型や効能などを開発計画に反映することに加え、医療事故防止対策の一環として、製品の識別性向上、注意喚起文書の配布などに主体的に取り組み、患者さんの安全の確保を図っています。
医療過誤の防止
医薬品の包装やラベルには、法律で規定された情報の提示を求められるなど多くの制限があるため、各社のデザインが類似することとなり、医薬品の取り違えなどの一因になっています。
そこで、当社では、サプライチェーン本部が中心となって、医療現場における取り違え防止に向けた包装・表示デザインの改善など、医療機関や患者さんの要望に応える取組を進めています。特に、医薬品は取り違うと重大な問題が発生しかねないことから、識別性の高い包装表示に努めています。既存品に、名称や包装デザインの類似がないことを確認してから発売していますが、それでも取り違えが発生するような場合は、その製品に関係する企業と協議の上、取り違えがないよう名称やデザインを変更するなど、早急に対応しています。
ピッチ印刷の採用
当社は、製品の識別性向上を目的として、PTPシートへのピッチ印刷の採用を拡大し、製品の安全対策に努めています。1錠ごとに、製品名と含量を記載することで、シートを切り離した時の取り違え防止が期待できます。

ボトル容器のふた(天面)への製品名印刷の採用
当社では、錠剤やボトル容器のふた(天面)への製品名印字や識別性の高い包装・表示デザインへの改善など、医療機関や患者さんによる医薬品の取り違えを防ぐための取組を進めています。当社は、製造ラインの中で、錠剤を入れるボトル容器のふた(天面)に製品名をレーザー印字できる仕組みを業界で初めて採用しました。医療機関では、こうしたボトル容器を引き出しに格納していることが多く、ふた(天面)にも製品名を表示することで、より取り出しやすくなります。

個装箱「情報カード仕様」の採用

情報カード仕様の個装箱とは、個装箱の側面にある製品情報を簡単に切り離せる機能を有した個装箱です。切り離した製品情報は、PTPシートと一緒に保管し、調剤棚の引き出しに収納することができます。必要な情報を製品と一緒に保管することで在庫管理に寄与しています。