Investor Reports 第205期 中間株主通信
トップメッセージ


当社グループの2024年度第2四半期の事業概要(2024年4月1日から2024年9月30日まで)をご報告申し上げるにあたり、皆さまからの温かいご支援、ご理解に対し、厚く御礼申し上げます。
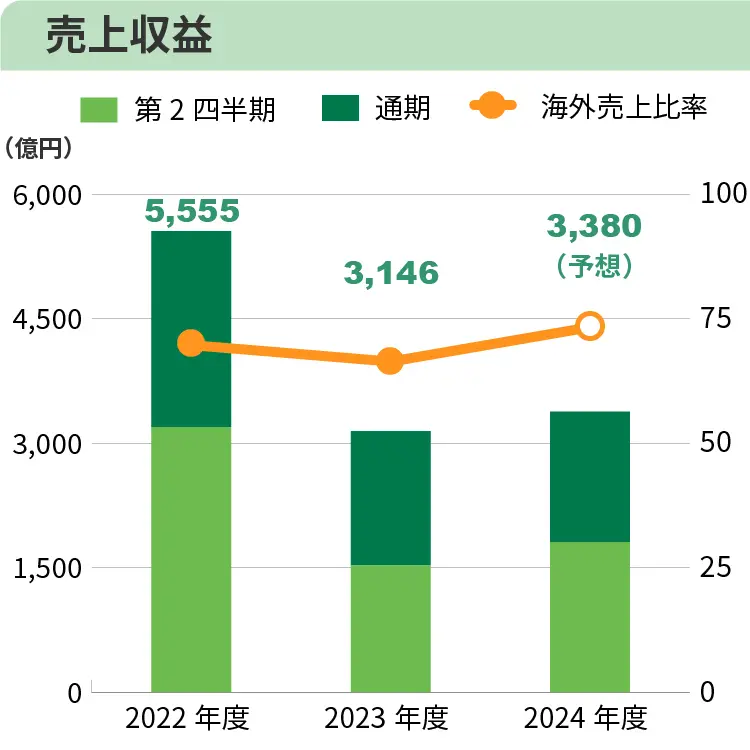
2024年度第2四半期は、米国において販売中の基幹3製品である進行性前立腺がん治療剤「オルゴビクス」、子宮筋腫・子宮内膜症治療剤「マイフェンブリー」および過活動膀胱治療剤「ジェムテサ」の売上が拡大したこと等から、連結売上収益は1,807億円(前年同期比281億円増)となりました。
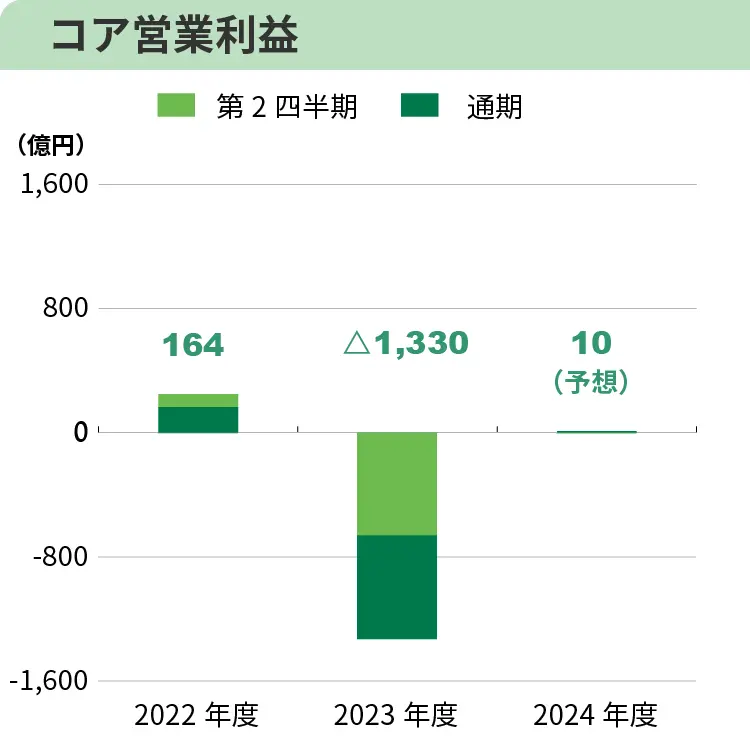
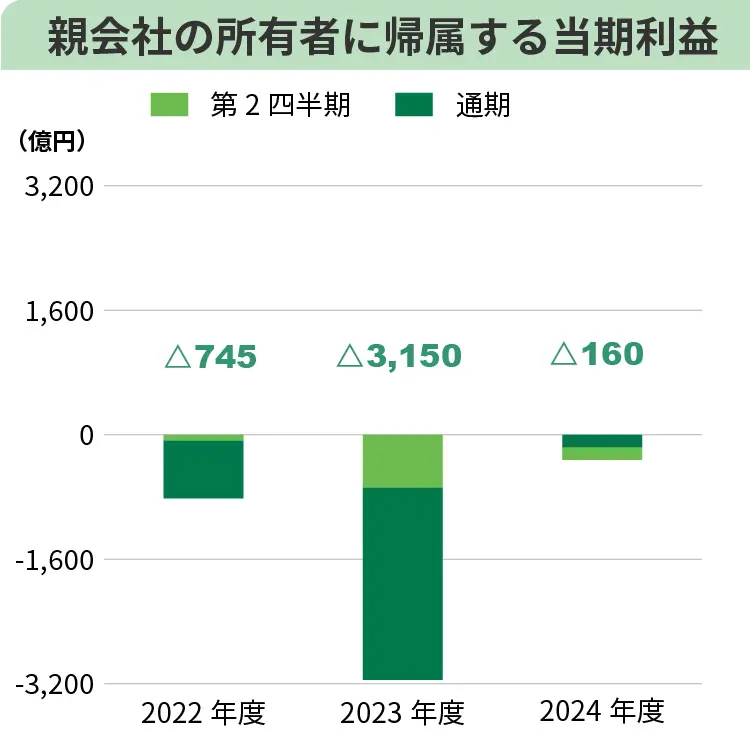
コア営業損益は、売上収益の増加に加え、北米グループ会社の再編等による事業構造改善効果の発現や研究開発投資の選択と集中による削減等、グループをあげて合理化を進めたことにより販売費及び一般管理費、研究開発費が大きく減少し、0億円の損失(前年同期は658億円の損失)となり、前年同期と比較し大幅に改善しました。親会社の所有者に帰属する中間損益は、為替相場の変動に伴う海外子会社保有の外貨建負債の評価により、金融費用(為替差損)を計上しましたが、コア営業損益が改善したこと等により、322億円の損失(前年同期は677億円の損失)となり、前年同期と比較し改善しました。
通期の連結業績予想については、第2四半期経過時点の売上収益は高進捗ですが、交渉中の事業譲渡等の成否・規模等、不確定要因もあり、売上収益3,380億円(前年度比234億円増)、コア営業利益10億円(前年度は1,330億円の損失)、親会社の所有者に帰属する当期損失160億円(前年度は3,150億円の損失)から変更しないことといたしました。
研究開発におきましては、重点疾患領域として注力するがん領域において、大型化を期待するenzomenib(DSP-5336)については、2024年6月に米国食品医薬品局(FDA)より、MLL (mixed-lineage leukemia)遺伝子の再構成またはNucleophosmin 1(NPM1)遺伝子の変異を有する再発または難治性の急性骨髄性白血病を対象としたファストトラック※の指定を受けました。 骨髄線維症の新しい治療法になることを期待しているnuvisertib(TP-3654)とともに、早期の上市を目指して、臨床開発を推進しています。精神神経領域では、他家iPS細胞由来ドパミン神経前駆細胞のパーキンソン病を適応症とした日本での承認申請について、PMDAとの協議を踏まえて申請⽬標を再検討中です。一方、米国で実施中のフェーズ1/2試験については加速してまいります。
配当方針は、業績に裏付けられた成果を適切に配分することを重視しており、安定的な配当に加えて、業績向上に連動した増配を行うこととしています。2024年度の業績見通しにつきましては、基幹3製品の販売拡大により売上収益は増収を見込むものの、コア営業利益は10億円と、「中期経営計画2027」で想定したコア営業利益を大きく下回っていることから、2024年度の配当については、誠に遺憾ながら無配を予定しています。株主の皆様には、深くお詫び申し上げます。
当社グループは、今後も全社一丸となって事業活動を推進し、早期の業績回復に努めてまいりますので、株主の皆様におかれましては、何卒ご理解のうえ、引き続きご支援を賜りますようお願い申し上げます。
2024年11月
- ※ ファストトラック:重篤または生命を脅かす恐れのある疾患やアンメット・メディカル・ニーズの高い疾患に対し、治療効果が期待される 治療法の開発・審査の迅速化を目的とした制度
- ※グラフは、IFRSコアベースの数値を記載しています。
セグメント別概況
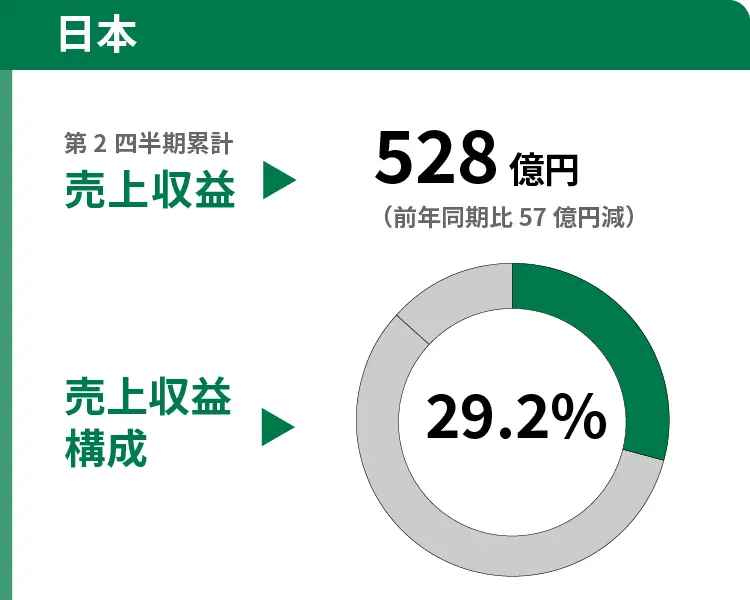
非定型抗精神病薬「ラツーダ」や2型糖尿病治療剤「ツイミーグ」などの売上が伸長しましたが、パーキンソン病治療剤「トレリーフ」の独占販売期間が終了したことによる売上減少に加え、薬価改定の影響が大きく、減収となりました。
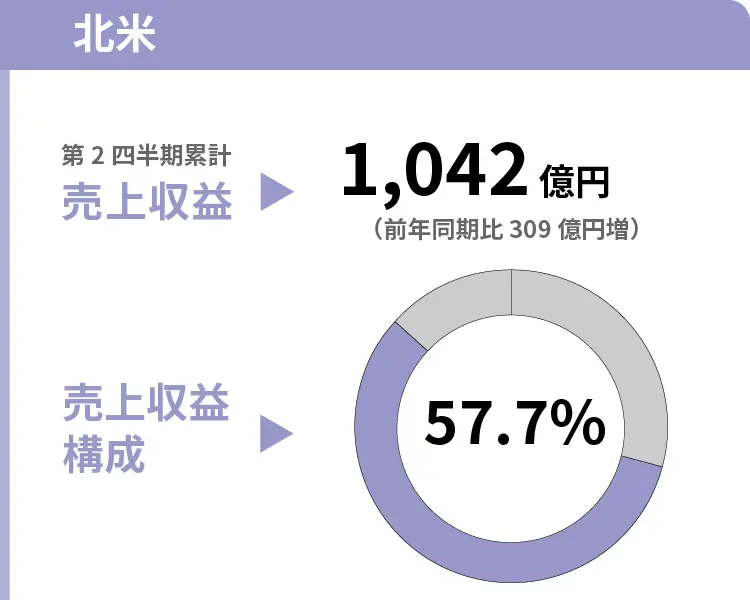
基幹3製品の進行性前立腺がん治療剤「オルゴビクス」、子宮筋腫・子宮内膜症治療剤「マイフェンブリー」、過活動膀胱治療剤「ジェムテサ」 および抗てんかん剤「アプティオム」の売上が伸長したことに加え、為替換算の影響により、増収となりました。
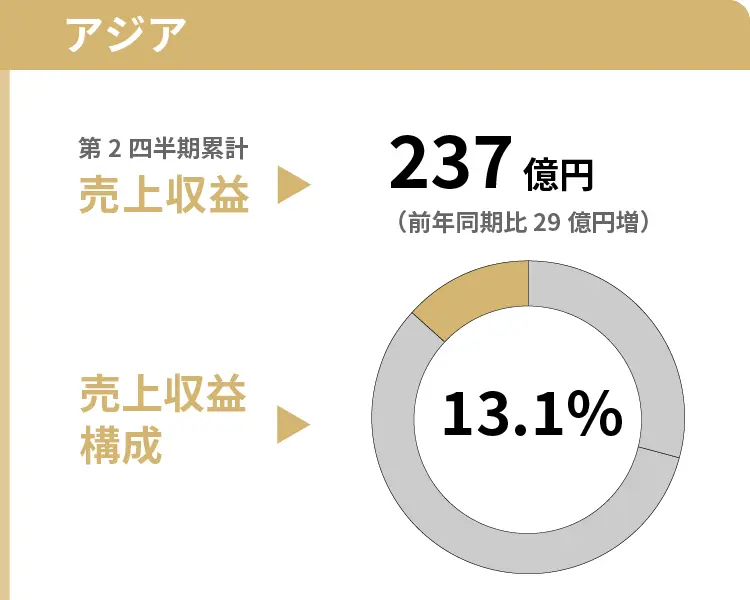
中国において、カルバペネム系抗生物質製剤「メロペン」の売上が増加したこと等により、増収となりました。
特集
がん領域の2化合物の開発推進

当社は、「がん領域」を重点疾患領域の一つとして、研究開発に取り組んでおり、早期の上市が期待できる、自社創製の化合物であるnuvisertib(TP-3654)およびenzomenib(DSP-5336)の開発に注力しています。
nuvisertib は、世界初の作用機序である選択的PIM1キナーゼ阻害剤です。造血器腫瘍の一種である骨髄線維症を対象に開発を行っており、2027年度に日米での上市を計画しています。
enzomenibは、京都大学との共同研究にて見出された化合物であり、米国食品医薬品局(FDA)よりファストトラック※指定を受けています。造血器腫瘍の一種である急性白血病を対象に開発を行っており、2026年度に急性骨髄性白血病を対象に日米での上市を計画しています。
また、両化合物はFDAからオーファンドラッグ指定を受けており、enzomenibは厚生労働省から希少疾病用医薬品指定を受けています。
両化合物が対象とする造血器腫瘍は、アンメット・メディカル・ニーズが高く、新しい効果的な治療選択肢が求められており、当社は世界のがん患者さんやそのご家族に価値のある薬剤をいち早くお届けできるよう取り組んでいきます。
- ※ ファストトラック:重篤または生命を脅かす恐れのある疾患やアンメット・メディカル・ニーズの高い疾患に対し、治療効果が期待される 治療法の開発・審査の迅速化を目的とした制度

